Супрамолекулярная химия(СХ) – относительно новый раздел химии, рассматривающий соединения, молекулярные ансамбли, ассоциаты стехиометрического и нестехиометрического составов, компоненты которых связанны между собой межмолекулярными (невалентными) взаимодействиями. Иными словами СХ – это химия невалентных взаимодействий. К настоящему моменту это наиболее распространенное, хотя и не всеми принятое определение предмета супрамолекулярной химии, что указывает на молодость рассматриваемой научной дисциплины и размытость границ ее действия, но об этом несколько ниже.
Термин «с упрамолекулярная химия» был введен в 1973 году Лауреатом Нобелевской премии по химии за 1987 год Ж.-М. Леном. По Лену предмет супрамолекулярной химии можно разбить на две широкие, частично перекрывающиеся области, связанные с: а) - химией супрамолекул, возникающих в результате молекулярного распознавания и последующей межмолекулярной ассоциации двух или нескольких компонентов - рецептора и его субстрата, и которые строят молекулярный каркас из одного сорта молекул (хозяин), в полости которого внедряется другой сорт молекул (гость), и б) - химией молекулярных ансамблей, возникающих в результате спонтанной ассоциации неопределенного числа компонентов и имеющих более или менее четко обозначенную микроскопическую организацию (клатраты, везикулы, мицеллы, мембраны; например, одна из разновидностей рибосомы состоит из 55 белковых молекул и трех молекул рибонуклеиновой кислоты, образующих глобулу с размером порядка 200 Å). Сила взаимодействия в этих конструкциях может колебаться от слабых, наблюдаемых, например, в газовых гидратах и образованных за счет водородных связей, до сильных, образованных д.-а. связями, наблюдаемых, например, в краун-соединениях. При этом следует иметь ввиду, что образование подобных соединений зачастую приводит к стабилизации как хозяйских молекул, строящих каркас и находящихся, например, в энергетически менее выгодной конформации по сравнению с свободной молекулой, например, конформации типа «ванна», так и молекул гостей, иногда даже не существующих в индивидуальном состоянии (например, радикалы). Это явление получило свое особое название «контактная стабилизация молекул». Отсюда следует, что понятие супрамолекулярная химия объединяет самые различные классы веществ, начиная от веществ, рассматриваемых в курсе неорганической химии, и кончая веществами, являющихся предметом химии живого. Из вышесказанного также следует, что многие исследователи изучали вещества, связанные невалентными взаимодействиями, еще задолго до первой формулировки термина супрамолекулярная химия. Более того, большинство терминов, вошедших в это понятие, было предложено в конце XIX и начале XX веков.
Клатраты (термин в его современном понимании предложен в 1947 г Пауэллом) или соединения включения (термин преложен Шленком в 1949 г), видимо впервые были замечены Пьером, Бертло и Кронстедтом в 40-50 г.г. XVIII века, но детально описаны Пристли в 1778 г («аномальный» лед – гидрат сернистого газа). Пелетье и Карстен в 1785 г описали образование «окиси мурия», которая в действительности оказалась гидратом элементарного хлора, что доказал Дэви в 1811 г. При этом состав этой «окиси» (Cl2×10H2O) был определен в 1823 г. Фарадеем, а структура только в 1952 г. Штакельбергом и Мюллером.
Сейчас под клатратами понимают надмолекулярные соединения включения, образованные только за счет вандерваальсовых взаимодействий молекул-гостей с молекулами другого сорта, называемых хозяйскими, из которых построен каркас с полостями для приема гостя. Термодинамическая устойчивость таких соединений обеспечивается подходящей геометрией расположения молекул гостей в полости хозяина (пространственное соответствие, комплементарность), благодаря чему образование слабых, но многочисленных межмолекулярных связей приводит к некоторому выигрышу энергии по сравнению с энергией составляющих клатрат компонентов. При этом каких-либо макроизменений, обычно проявляющихся при образовании более прочных связей, в компонентах соединений включения не обнаруживается. Соотношение компонентов в клатрате, т.е. его стехиометрия, может быть переменным, как в соединениях гидрохинона с инертными газами, так и строго определенным, как в соединениях мочевины с парафинами, в большинстве газовых гидратов или того же гидрохинона, но образующего соединения с сероводородом или фуллеренами.
В значительной степени стехиометрия определяется устойчивостью каркаса хозяина. Если каркас в отсутствие гостя неустойчив или вообще не существует, то образуется клатратное соединение постоянного состава. Если каркас хозяина термодинамически устойчив и в отсутствие гостя, то в этом случае образуются твердые растворы на основе исходной a-модификации, т.е. взаимодействие не сопровождается образованием новой фазы, хотя некая стабилизация общей структуры и происходит. Иными словами, клатратный каркас в последнем случае метастабилен по отношению к исходной a-модификации, но при некоторой степени заполнения пустот молекулами или атомами гостя становится устойчивей ее и образует клатрат переменного состава.
Следует подчеркнуть, что в подавляющем большинстве случаев хозяин не существует в той форме, в которой он существует в виде клатрата. Нужная для образования клатрата модификация хозяина и конформация гостя достигаются при их прямом или каскадном взаимодействии. В последнем случае имеет место ряд последовательных стадий клатратообразования. Например, глобин (белковая молекула гема) включает сперва без валентного взаимодействия железопорфириновый комплекс, который при этом приобретает конформацию чаши и который затем включает в себя молекулу кислорода или окись углерода. Это положение расходится с более простым, но в силу ряда других причин более распространенным предположением Фишера о том, что высокая специфичность ферментативных реакций обусловлена комплементарностью (принцип ключ-замок) субстрата и фермента. Вообще роль белкового окружения фермента, содержащего металлический центр, как в глобине, или металлический кластер, как в нитрогеназе или ферродоксинах, отнюдь не вторична. Это система, в которой ни один компонент не работает без другого. Наиболее яркий пример этому - безуспешные попытки в 70-80 г.г. смоделировать работу нитрогеназы, используя только Fe-Mo-S кластер кофактора нитрогеназы.
По форме полости в клатрате соединения включения классифицируются на крипто-клатраты (клетки), тубулато-клатраты (трубки) и интеркалато-клатраты (слоистые соединения включения). По характеру взаимодействия «гость-хозяин» они подразделяются на простые клатраты, например канальные соединения мочевины с парафинами, образующиеся только за счет вандерваальсовых сил (межмолекулярных невалентных взаимодействий), координато-клатраты, например клеточный гидрат триметиламина, образованный за счет водородных связей (при специфических взаимодействиях) (цельное название – криптато-координато-клатрат), и клатрато-комплексы – более прочные образования с донорно-акцепторными связями.
Существует также классификация по характеру связей в хозяйском каркасе. Это решетчатые клатраты, в который хозяйский каркас построен из молекул, связанных относительно слабыми связями, например, водородными. Типичными представителями клатратов этого типа являются гидрохинон и фенолы, имеющие ОН-группы. Через эти группы строится каркас, состоящий из шести хозяйских молекул (рис. 16). Термическая стойкость такого клатрата может быть на несколько десятков градусов выше температуры плавления каждого из компонентов.
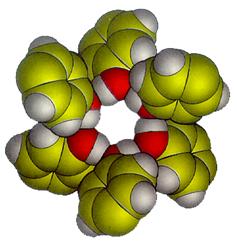
Рис. 16. Полость хозяина, составленная из шести молекул гидрохинона.
В макромолекулярных клатратах каркас построен из ковалентносвязанных фрагментов. В качестве примера можно привести интенсивно исследующиеся в последние годы каркасные координационные соединения или MOF-структуры (metal-organic framework’s) (рис. 17), которые мы рассмотрим ниже при обсуждении проблем аккумулирования газов (метана, водорода, ацетилена, двуокиси углерода) или клатросил с формульной единицей SiO2. В полостях последнего могут располагаться те же гости, что и
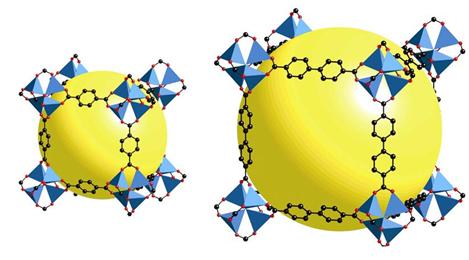
Рис. 17. MOF’s на основе карбоксилатов цинка с линкерами различной структуры. Желтый шар – объем полости в полимере
в гидратах, поскольку их размеры близки, но термическая устойчивость их существенно выше и для клатрата с триметиламином может достигать 3 часов экспозиции при 950 Со против 200 Со в гидрате.
В мономолекулярных клатратах хозяин состоит из крупных молекул, каждая из которых имеет одну или несколько полостей. Эти соединения могут существовать и в растворах. Примером подобных клатратов является окрашенное в синий цвет соединение иода с амилозой крахмала.
Наиболее типичными и интересными среди этих веществ являются клатратные гидраты, которые могут содержать как газовые компоненты, о них мы поговорим ниже, так и более сложные молекулы, в том числе и ионные комплексы, например соли тетраалкиламмонийных оснований. В последнем случае водный каркас строится вокруг аниона, а катион, внедряясь в большие полости каркаса, стабилизирует клатрат в целом. Аналогичный эффект наблюдается и в ряде клатратов на основе координационных соединений, в каркас которых внедряются молекулы растворителя и стабилизируют их (эффект контактной стабилизации). Так, пиридил-роданидные комплексы меди или цинка сами по себе неустойчивы, но их клатраты с бензолом вполне стабильны. Зачастую, однако, молекулы гостя не влияют на свойства хозяина и поэтому образующиеся с их участием соединения иногда называют «упаковочными комплексами». Этот очень распространенный тип соединений внедрения не только в координационной, но и металлорганической химии, видимо, впервые наблюдался Гоффманом в 1897 г на примере комплекса никеля состава Ni(CN)2NH3×C6H6.
Весьма распространенными являются клатраты на основе мочевины (рис. 18). В клатратном каркасе ее b-модификации все Н-связи распрямлены и плотность резко снижена по сравнению с исходной a-модификацией. В силу этого она сама по себе не может существовать и стабилизируется, включая в свои трубчатые полости молекулы гостя -. в данном случае парафина.
Слоистые соединения, соединения внедрения, интеркалированные соединения – все это один класс клатратных соединений, в которых атомы или молекулы гостя располагаются в межслоевом пространстве или геометрических пустотах кристаллической решетки. Наиболее известные среди них - соединения внедрения в графит и фуллериды, классифицированные выше как ион-радикальные комплексы с переносом заряда или интеркалато-клатраты.
Замечательными по своему разнообразию являются клатраты гидрохинона (рис. 19), существующего в трех устойчивых модификациях и дополнительно дающего термодинамически нестабильный d-каркас, возникающий только в результате реакции клатратообразования с инертными газами, сернистым ангидридом, двуокисью углерода,
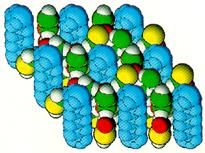
Рис. 18. Молекулы n-парафина в канальных полостях клатратного каркаса из молекул мочевины.
галоидными алкилами, метаном, и даже огромными по размеру молекулами фуллерена (рис. 20) и т. д.
Среди всех известных клатратов с практической точки зрения наибольший интерес представляют газовые, прежде всего метановые гидраты. Особый интерес к ним возник после открытия метановых гидратов в недрах Земли и океана, запасы топлива в которых превышают все другие запасы топлива вместе взятые. Предполагается, что многие глобальные катастрофы на Земле, в том числе в период триаса 230 млн. лет назад и в

Рис. 19. Полость в структуре β-гидрохинона с включенной молекулой ксенона
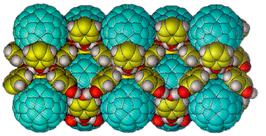
Рис. 20. Фрагмент δ-структуры соединения С60∙3Q
эпоху палеоцена 55 млн. лет назад, вызвано катастрофическими выбросами в атмосферу миллиардов тонн метана, находившегося в «стационарных» условиях в глубинах океана в виде газовых гидратов под давлением и при низких температурах. Или катастрофа, произошедшая 8000 лет тому назад на берегах Норвегии, когда газ, выделившийся с шельфа площадью несколько тысяч кв.км., поднял цунами высотой несколько сотен метров. Уже в наше время (1986 г) спонтанное и неожиданное разложение газовых гидратов кратерного озера Ниос (Камерун), содержащих сероводород, сернистый газ, метан, двуокись углерода привело к гибели 1700 человек. Одна из гипотез, объясняющая тайны Бермудского треугольника, также основана на предположении выделения из глубин Океана огромных газовых пузырей метана. Еще более впечатляет гипотеза, объясняющая причины современного глобального потепления климата Земли. Она также связана с метаном: явное увеличение средних температур атмосферы и Океана привязывается к увеличению его количества в верхних слоях атмосферы, что приводит к увеличению поглощения теплового излучения. На него также пало частичное подозрение как на реагент, разрушающий озоновый слой. Однако все это относится к области научных предположений, хотя в настоящее время имеется достаточно много научно-обоснованных гипотез нестабильности газовых гидратов и причин их вызывающих (последнее – каналы внутри твердого слоя газового гидрата, начинающиеся от придонных трещин земной коры и обеспечивающие приток тепла в этот слой), а иногда и фантазий. Реальность же в том, что в одном кубометре «метанового льда», единичный фрагмент которого построен из 32 молекул воды и 8 молекул метана, содержится 164 кубометра природного газа, что всего лишь в 2-2.5 раза меньше, чем в жидком метане! И в таком виде его хранится 10000-15000 гигатонн! К сожалению, а может быть и к счастью, в настоящее время нет промышленных технологий использования этого богатства, но работы в этом направлении ведутся и, учитывая печальный «опыт» Норвегии и Камеруна, вряд ли однозначно положительно можно будет оценить успешное окончание этих работ.
Структура газовых гидратов определяется каркасом, построенным из молекул воды, связанных водородными связями. В настоящее время известно более 15 таких каркасов, имеющих большие (основные) и малые (дополнительные или стабилизирующие) полости. Полиэдры, описывающие полости, также самые различные. Из них наиболее типичны 12, 14, 15, 16 и 20- гранники, обычно обозначаемые, соответственно, первыми буквами греческого алфавита – D, T, P, H и Е (рис. 21) (существуют и несколько отличные от этого обозначения полостей газовых гидратов).
Их многообразие определяется тетраэдрической координацией молекул воды и заметной гибкостью Н-связи по длине и валентному углу, что дает возможность строить различные каркасы, мало отличающиеся по энергиям. Длины связей и валентные углы изменяются в пределах «основного» положения типичного для обычного льда –2.76 Å и
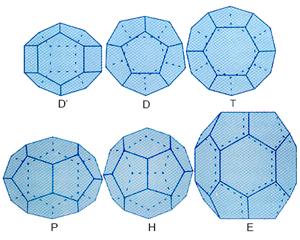
Рис. 21. Полости-многогранники в водных клатратных каркасах (в вершинах многогранников расположены атомы кислорода, ребро обозначает водородную связь)
109.5 о. Образующиеся при этом решетки и, соответственно, составы соединений газовых гидратов также достаточно разнообразны и помимо всего зависят от давления, при котором они находятся. Для газовых гидратов наиболее характерны кубические КС-I и КС-III решетки и гексагональная ГС-III (в англоязычной литературе – structure H) решетки с формулами элементарной ячейки 6Т·2D·46H2O, 8H 16D·136H2O и E·2D’·3D·34H2O, в которых помимо количества каркасообразующих молекул воды указывается количество молекул или атомов гостя и буквами тип пустот, которые они занимают. Известны также тетрагональные решетки, которые обычно образуются при высоких давлениях. В качестве каркасов рассматриваются и рыхлые формы льда лед Ih, лед Ic и лед II, существующие при высоких давлениях. На рис. 22 приведена структура одного из таких газовых (метановых) гидратов в общепринятом обозначении полостей.
Стабильность газовых гидратов зависит от структуры каркаса (степени и качества заполнения больших и малых полостей), температуры, давления и некоторых специально вводимых добавок. Так, решетка ГС-III, имеющая самую большую полость Е, не стабильна, если не будут заполнены малые полости D. В то же время минимальные Р,Т- условия, при которых становится устойчивым метановый гидрат, - 0оС и давление 25-30 атм. С увеличением давления его устойчивость возрастает и при 2-2.5 Кбар он существует уже при 40-50 оС. Введение в систему третьего компонента – тетрагидрофурана или метилциклогексана в еще большей степени стабилизирует систему и снижает Р,Т параметры устойчивости метанового гидрата. При этом органические добавки также включаются в полости газового гидрата, образуя смешанные соединения (рис. 23).
Рис. 22. Структурный фрагмент КС-1 с молекулами метана в D и Т полостях
Рис. 23. Структура метановых гидратов с добавками тетрагидрофурана (а) и метилциклогексана (б)
При давлениях до 15 Кбар и обычных или пониженных температурах становятся устойчивыми клатратогидраты неона, аргона и даже водорода составов Н2/Н2О=1 и Н2/2Н2О=1. Последние построены на основе каркасов из льда II или льда Iс и содержат 11.2 и 5.3 масс. % Н2, соответственно. Цифры в других случаях труднодостижимые, например, в металлических гидридах или специально синтезированных сорбентах на основе углерода, цеолитов или низкоплотных комплексных соединений весовое количество водорода существенно ниже. Подобные вещества могут быть стабильны при низких температурах даже при обычном давлении, а при высоких давлениях (>300 атм) или в присутствии небольшого количества третьего компонента, например, тетрагидрофурана или алкиламмонийной соли (рис. 24) могут быть вполне устойчивыми и при комнатной температуре и сравнительно невысоком избыточном давлении (<100 атм).
Комбинация двух газообразных гостей - водорода и метана и одного жидкого - тетрагидрофурана на сегодняшний день является уникальной по содержанию горючего

Рис. 24. Структура клатрата, образующегося в системе Н2-Н2О-NR4Br, и зависимость его устойчивости от давления и температуры.
компонента – водорода. Рассчитанное количество водорода в соединении состава (Н2)4·СН4 33.4 масс. % и существует оно при 2 Кбар и температуре 77 К, в то время как при 300 К требуется давление 50 Кбар. Но это пока неподтвержденные данные, которые могут быть далеки от реальности.
В последние годы заметно взросли исследования клатратов на основе циклодекстрина – циклического олигосахарида, построенного из 6, 7 или 8 d-гликопиранозных звеньев (рис. 25.
Геометрию молекулы циклодекстрина можно представить в виде корзины без дна, на верхней части которой располагаются 12-16 вторичных ОН-групп, а на нижней 6-8 первичных или их функциональные заместители («хвосты с кисточкой»). Эти вещества, которые могут, в зависимости от числа гликозидных звеньев, изменять диаметр верхней части «корзины без дна» от 5.7 до 9.5 Å (и, соответственно, нижней, но в меньших пределах), видимо, исключительно за счет вандерваальсовых взаимодействий включают в свою полость самые разнообразные субстраты. В ряде случаев это позволяет произвести не

Рис. 25. Строение молекулы циклодекстрина
только их селективный отбор, но и провести в полости циклодекстрина селективную каталитическую реакцию и обычные синтетические реакции (т.е. работать как «нанореактор»), но приводящие к необычным и труднодоступным продуктам, таким, например, как катенаны, ротоксаны, полиротоксаны и трубки, т.е. компонентам или заготовкам, используемым в качестве строительных блоков при получении наноразмерных структур или более сложных объектов супрамолекулярной химии.
Помимо решения чисто химических задач циклодекстрин начал успешно использоваться в биохимии, например для определения in vitro противовирусной или противогрибковой активности производных ферроцена. Модель структуры комплекса, использующегося для этой цели, показана на рис. 26.

Рис. 26. Модель структуры комплекса циклодекстрина с замещенным ферроценом.
Несмотря на очень широкое распространение в природе, большое внимание исследователей к клатратным соединениям и их длительную историю, все же началом формирования понятия супрамолекулярная химия и выделение ее в самостоятельную область знания следует считать открытие Педерсеном краун-эфиров (на рис. 27 приведены модели структур наиболее известных краун-эфиров) и обнаружение их уникальной способности к захвату в свою полость катионов щелочных (рис. 28-30) металлов. Прочность и геометрия образующихся комплексов или краун-соединений обусловлены многими причинами, но, прежде всего, геометрическим соответствием размера полости размеру гостя (принцип геометрического соответствия): большая по размеру молекула или ион не образует внутриполостных соединений, хотя и могут координироваться снаружи лиганда, а меньшие по размеру дают менее прочные внутриполостные


Рис. 27. Графическое изображение некоторых краун-эфиров
соединения, поскольку требуют более глубокой перестройки структуры макроцикла. Однако в любом случае комплексообразование сопровождается перестройкой структуры краун-эфира иногда в симметричную коронообразную молекулу, венчающую, как голову монарха, ион металла. Последовавший за этим открытием синтез криптандов, аза- и сера-краун-эфиров и их гетероаналогов существенно расширил ассортимент и возможности полициклических молекул в плане их применения в аналитической химии, межфазном катализе, экстракции и т.д. Однако все эти соединения недостаточно хорошо организованы для приема гостя. Их выравнивание требует дополнительной энергии, что сказывается на общей устойчивости комплекса.
На следующем этапе развития химии макроциклических молекул были синтезированы сферанды, кавитанды, карцеранды, геми- и криптосферанды, каликсарены, катапинады и лариаты (рис. 31-36). Большая часть этих веществ имеет жесткую хорошо организованную структуру, которая идеально подходит для приема гостя. Например, в сферандах и кавитандах это чаша, в карцерандах это емкая полость (пещера).
Здесь возникает вопрос, а правомерно ли выделение соединений макроциклов с ионами металлов в самостоятельный от классических координационных соединений, например, сольватов, образованных n-донорами, или гидратов. Однозначного ответа у меня нет. По своей сути – это координационные соединения. Прежде всего, в большей части ионных краун-соединениях связь между компонентами обеспечивается за счет обычной д.-а. связи и в комплексах даже может иметь место валентный контакт между ионом и донорными атомами кислорода, азота или серы, причем образование этих веществ настолько термодинамически выгодно, что их можно получить прямым

Рис. 28. Модель структуры комплекса дибензо-18-краун-6 с ионом калия состава 1:1

Рис. 30. Модель структуры комплекса дибензо-18-краун-6 с ионами натрия состава 2:1

Рис. 29. Модель структуры комплекса 12-краун-4 с ионом калия состава 2:1
взаимодействием макроцикла с металлом в подходящем растворителе. При этом образуются такие удивительные ионные соединения, как алкалиды состава М+×МЦ×М’- (M=M’ – Li, Na, K, Rb, Cs; M’- Au), еще более необычные состава Na22-∙МЦ∙Са2+, Na-∙МЦ-∙Ва2+ (рис.) или электриды М+×МЦ×е_ (МЦ- макроциклический лиганд). Ионное строение
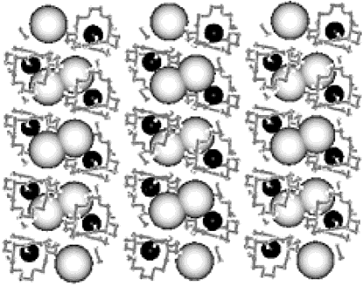
Рис. Структура азакриптанада Ba+2(H5Aza222)- Na- ∙2MeNH2. Черные шары - катионы бария, серые - анионы натрия
этих веществ является безусловным доказательством валентных взаимодействий в молекуле и по этому признаку алкалиды и электриды нельзя отнести к предмету СХ. Но в то же время их нельзя отнести и к веществам, рассматриваемым в рамках координационной химии, прежде всего по механизму образования, составу, строению и свойствам, которые ближе к растворам щелочных металлов в жидком аммиаке. Но и без этого, в целом, особенности свойств краун-соединений, их состав и строение резко отличаются от классического варианта д.-а. комплексов. В реакциях с КЭ «сольватации» подвергаются такие ионы, как аммоний и алкиламмониевые основания, ионы тяжелых щелочных и щелочно-земельных металлов, которые не сольватируются другими «классическими» лигандами, хотя могут образовывать достаточно прочные комплексы с хелатирующими лигандами, например диглимом, но их не относят к предмету СХ. При этом структура и прочность образующихся соединений, например комплексов 18-К-6 с ионами калия и аммония,
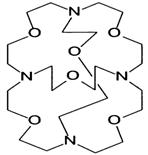
Рис. 31. Модель структуры одного из криптандов (аминоэфиров)
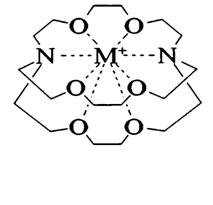
Рис. 32. Модель структуры [2,2,2]криптанда с ионом металла в полости
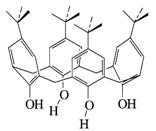
Рис. 33. Модель структуры одного из простейших каликсаренов
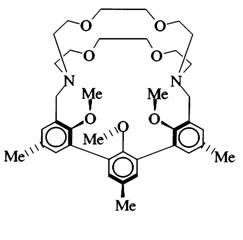
Рис. 34. Модель структуры криптосферанда
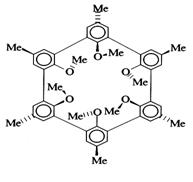
Рис. 35. Молекула сферанда
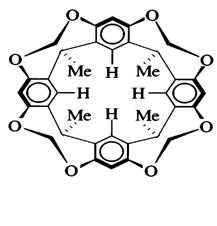
Рис. 36. Модель структуры кавитанда


имеющих приблизительно одинаковый размер, также примерно одинакова, хотя энтальпии этих реакций почти всегда близки к нулю, а двигателем термодинамической
предпочтительности является изменение энтропийного фактора. Вследствие этого термин «сольватация» ограниченно применим к краун-соединениям, поскольку в химии д.-а. комплексов имеет несколько другой смысл.
Уже из факта существования алкалидов и электридов следует, что могут быть получены макроциклические соединения специфические только по отношению к анионам. Действительно, такие соединения на основе макроциклических перфторарилмеркуратов были получены и успешно применены как ловушки анионов.
Соединения нейтральных молекул с макроциклическими молекулами уже, безусловно, можно отнести к предмету СХ. Таких соединений в настоящее время известно тысячи. Как минимум, их образование сопровождается процессами распознавания (для простых структур, типа КЭ или криптандов, это в основном геометрическое или, как говорят, «сферическое» соответствие, для более сложных это уже может быть и «тетраэдрическое». «линейное» или даже электронное распознавание), самоорганизации (подстройки структуры хозяина под структуру гостя, спонтанное возникновение порядка в пространстве и /или во времени) или даже спонтанной самосборки – процесса более высокого порядка, который приводит к образованию сложных супраструктур, состоящих из нескольких компонентов. Как видно, все эти термины пришли в СХ из биохимии, в которой также рассматриваются вопросы самосборки (репликации) молекул нуклеиновых кислот в ходе матричного синтеза белков, образование металлоферментов и пр. В этом смысле все эти биохимические объекты также являются объектами супрамолекулярной химии.
Метод матричного синтеза с успехом применяет не только природа, но и химики в лабораториях, правда под другим названием – темплатный или темплейтный синтез. В частности его использование привело к разработке эффективного способа получения катенанов – органических молекул типа «кольцо в кольце» («классические» варианты темплатного синтеза фталоцианинов и порфириновых оснований с участием ионов переходных металлов мы рассмотрим в разделе координационная химия). Использование контейнерных соединений типа карцеранов как объемной матрицы, ограничивающий реакционный объем и защищающий создаваемые молекулы от внешнего воздействия, т.е. в качестве нанореактора, позволило не только осуществить в их полости синтез неуловимого циклобутадиена – важного для подтверждения теории химической связи (проблема ароматичности и антиароматичности) вещества, но и сохранить его при обычных условиях в течение нескольких десятков минут. В стандартном органическом синтезе это вещество не могли получить более ста лет, а в условиях криохимического способа синтеза оно хотя и было получено, но даже небольшой нагрев приводил к его гибели.
Разделение изотопов (хотя реализация этой технологии все еще остается под большим вопросом и с моей точки зрения вряд ли осуществима) и изомеров, в том числе и стерео-, фотодиагностика и фототерапия рака, селективный перенос ионов через клеточные мембраны, связывание и вывод вредных веществ из организма, мембраны для ионселективных электродов и оптодов, и, наконец, материаловедческий аспект, связанный с конструированием молекулярных устройств типа молекулярных переключателей, реагирующих, например, на изменение рН среды – вот далеко не полный перечень применения и возможного применения макроциклических соединений.
Более фантастические планы использования подобных соединений связаны с построением на их основе молекулярного компьютера. Для этого необходимо объединение нескольких типов молекул и созданием молекулярного ансамбля, каждый элемент которого выполняет функцию, присущую микропроцессору. Безусловно, это сложнейшая задача, которая требует не только изучения механизмов самосборки молекулярных агрегатов и определения условий их адаптации к информационным технологиям, но и, в принципе, фактически создания новой идеологии и новой технологии с приставкой нано. На пути решения этой сложнейшей задачи уже разработаны подходы к созданию молекулярных переключателей, например за счет фотохимически индуцированных реакций изомеризации молекул спиропиранов и спирооксазинов. Возможность варьирования структуры и состава этих соединений в очень широких пределах принципиально позволяет подогнать их свойства (квантовые выходы, времена жизни фотоизомеров, спектральные характеристики и т.д.) к требованиям того или иного молекулярного устройства. Помимо фотохромных систем рассматриваются и соединения с особыми магнитными свойствами, например, некоторые комплексы железа способные к переходу из низкоспинового в высокоспиновое состояние, происходящим с некоторым температурным гистерезисом.
В качестве возможного молекулярного носителя памяти рассматриваются трехмерные (3-D или многослойные устройства) системы, состоящие из слоев или элементов, построенных, например, из тех же молекулярных переключателей, одна из форм которых способна к флюоресценции, что и позволяет считывать информацию.
В качестве проводников между молекулярными переключателями и молекулярными элементами памяти на настоящий момент наиболее перспективными считаются электропроводящие полимеры, типа полиацетилена, полианилина, молекулярные комплексы карбина типа известного LL”Re(C)20ReLL’ или простых цепочек карбина типа обнаруженных недавно при изучении графеновых слоев (рис. 37). Единственный вопрос,

Рис. 37. Схема образования полииновой цепочки из атомов углерода (карбина), возникающей при разломе графенового листа, и расстояния между ними.
который возникает при обсуждении проблемы, каким образом собрать все эти элементы в одно устройство или супрамолекулярный комплекс: используя принцип комплементарности (молекулярного распознавания), который в супрамолекулярной химии, видимо, не имеет такого «мистического» значения как в химии живого, поскольку уже имеется достаточно много примеров, где он в явном виде никак не просматривается, например в т.н. mixed structure, хотя в этом случае комплементарность может действовать на атомном уровне или уровне групп, или какой-либо другой принцип, пока остается открытым. Однако интенсивные работы в этом направлении ведутся многими научными коллективами, поскольку цена вопроса очень велика. В этом отношении уже достигнуты очень серьезные успехи, особенно в сборке двумерных структур на основе мономолекулярных пленок Ленгмюра-Блоджет, наслаиваемых, например через 15-20 атомные металлокластеры, и создание с использованием этого сэндвича транизистора.
Размеры молекулярных структур допускают размещение на 1 см 2 поверхности примерно 1013 логических элементов, что в сотни тысяч раз больше плотности сборки, достигаемой в современных микрочипах. Время отклик в таких устройствах можно довести до фемтосекунд, тогда как самые быстрые современные устройства оперируют в наносекундном диапазоне. В итоге можно ожидать 1011-разового увеличения эффективности молекулярного компьютера по сравнению с наиболее мощными современными средствами обработки информации.
В заключение следует все же отметить, что предмет супрамолекулярной химии находится в стадии становления, его границы размыты, мода приводит к тому, что под звучное название, как под знамя, втискиваются объекты, которым было бы уютнее находиться в рамках традиционных и устоявшихся дисциплин. Но существуют и обстоятельства, требующие более детального разбора причин и следствий. Такие случаи часты, например, в современных типах молекулярных устройств, позволяющих конструировать фотокаталитические системы для конверсии солнечной энергии в химическую так, как это показано на рис. 38. В этой «конструкции» порфириновый комплекс является донором электронов, которые через проводящий спейсер с системой сопряженных связей, например состоящей из одномерной углеродной цепочки (карбина), поступают в «депо электронов» - молекулу фуллерена способную акцептировать до 12 электронов.
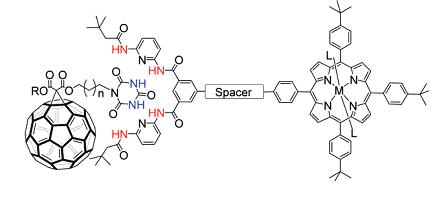
Рис. 38. Схема молекулярного устройства для преобразования солнечной энергии.
На рис. 39 показана уже реально разрабатываемая фотоактивная система – донорно-акцепторный гибрид, в котором молекулой продуцирующей электроны является одностенная углеродная нанотрубка, связанная через фрагмент краун-эфира с молекулой фуллерена.
Несколько иная ситуация рассматривалась выше при описании попыток создания молекулярного компьютера, часть которого, как полагают, также будет функционировать с участием фотохимически индуцированных реакций. Но возникает общий вопрос, каким образом будут связаны все компоненты этого компьютера или преобразователя солнечной энергии в фототок валентными или невалентными взаимодействиями? Если невалентными, то патетика вопроса исчезает, если же валентными, тогда возникает другой вопрос, а собственно чем этот сложный молекулярный ансамбль, составленный, как минимум, из трех компонент, отличается от других сложных многоатомных органических или
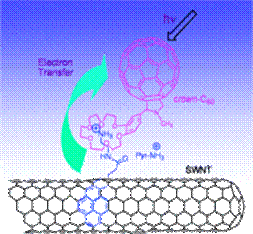
Рис. 39. Фотоактивная супрамолекулярная система на основе двух различных по природе углеродных молекул.
металлорганических молекул? Только интересным функциональным свойством? Но и в последних оно может присутствовать. Именно поэтому относить к предмету супрамолекулярной химии сложные молекулы, в которых функций-определяющие компоненты ковалентно связаны друг с другом напрямую или через спейсеры и это объединение только усиливает это свойство, мне представляется нецелесообразным (например, молекулы порфирина и хинона, связанные через разделяющий донор и акцептор бициклооктановый мостик, что позволяет существенно увеличить жизнь состояния с разделенным зарядом, или трисбипиридил рутениевый комплекс, связанный с молекулой фенотиазина через этиленовый мостик – оба примера относятся к фотохимическим молекулярным устройствам и являются эффективными переносчиками заряда и энергии в процессе фотовозбуждения молекулы).
Иное дело, когда в процессе фотовозбуждения и переноса заряда и обратных им процессам происходит разрыв ковалентной(ых) связей и образование промежуточных состояний с невалентными взаимодействиями. Тогда мы в полной мере можем отнести их к предмету супрамолекулярной химии. В этих примерах уже просматривается другой аспект современной химии, связанный с не менее модным в настоящий момент понятием с приставкой нано, прежде всего нанотехнологией. Более подробно этот аспект мы рассмотрим ниже. Здесь же сразу отметим, что предмет супрамолекулярной химии, никак и ни при каких обстоятельствах не связан с размерным фактором, в то время как в нанотехнологиях элементы, понятия и приемы супрамолекулярной химии могут присутствовать, а в ряде случаев даже определять получение некоего материала, устройства, молекулы с требуемым функциональным свойством.
В заключение я хотел бы отметить, что лично мне ближе следующая точка зрения: ионные краун-соединения, энергии образования которых близки к энергиям образования соединений с валентными взаимодействиями, хотя и явились катализаторами для кристаллизации понятия супрамолекулярная химия, но сами по себе все же являются предметом координационной химии, к рассмотрению некоторых аспектов которой мы и переходим.
 2018-02-13
2018-02-13 2991
2991








