Термодинамическая работа для всех простых тел определяется как работа изменения объёма

 Рассмотрим замкнутую систему, к которой подводится тепло при постоянном объёме. Так как объём не меняется, то термодинамическая работа равна нулю и тогда
Рассмотрим замкнутую систему, к которой подводится тепло при постоянном объёме. Так как объём не меняется, то термодинамическая работа равна нулю и тогда
 (5.6)
(5.6)
Таким образом, теплота, подводимая к замкнутой ТС, тратится только на увеличение внутренней энергии.
Пусть тело перешло из состояния 1 в состояние 2 тогда  , но в изохорном процессе (
, но в изохорном процессе ( )
)
 тогда
тогда
 (5.7) Следовательно, изменение внутренней энергии не зависит от вида процесса изменения состояния рабочего тела, а зависит только от начальной и конечной температуры этого тела. Т.к. удельная внутренняя энергия идеального газа является параметром состояния, то уравнение (5.7) действительно для её вычисления в любом термодинамическом процессе.
(5.7) Следовательно, изменение внутренней энергии не зависит от вида процесса изменения состояния рабочего тела, а зависит только от начальной и конечной температуры этого тела. Т.к. удельная внутренняя энергия идеального газа является параметром состояния, то уравнение (5.7) действительно для её вычисления в любом термодинамическом процессе.
При перемещении рабочего тела из области одного давления в область другого используется понятие потенциальной работы. 
|
|
|
 известно, что между
известно, что между  и
и 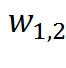 существует взаимосвязь
существует взаимосвязь 

В данном случае уравнение первого начала термодинамики примет вид

сгруппируем члены уравнения
 (а) В термодинамике принято называть
(а) В термодинамике принято называть
U+рV=Н – массовой энтальпией рабочего тела – потенциальной энергетической возможностью тела [Дж].
Удельная массовая энтальпия рабочего тела
h=u+р  [Дж/кг] (5.8)
[Дж/кг] (5.8)
она, как и внутренняя энергия является также параметром состояния, т.к. в правой части уравнения все члены – параметры состояния.
Подставим (5.8) в уравнение (а)
 (5.9) уравнение (5.9) является уравнением 1-го начала при перемещении рабочего тела из области одного давления в область другого.
(5.9) уравнение (5.9) является уравнением 1-го начала при перемещении рабочего тела из области одного давления в область другого.
Рассмотрим поток рабочего тела по каналу произвольной формы между сечениями 1 и 2. В соответствии с уравнением неразрывности массовый расход газа через сечения постоянен (G=const). Потенциальная работа, возникшая из-за разности давлений в сечениях, идёт на: 
| q |
 /2–
/2–  /2; -на изменение уровня высоты сечения 2 по отношению к сечению 1 g(z₂–z); -на совершение внешней работы w*₁,₂; -на преодоление сил трения в потоке
/2; -на изменение уровня высоты сечения 2 по отношению к сечению 1 g(z₂–z); -на совершение внешней работы w*₁,₂; -на преодоление сил трения в потоке  .
. 
подставим (5.10) в уравнение (5.9)
 (5.11).
(5.11).
Уравнение (5.11)– запись 1-го начала термодинамики для потока, используется для описания движения газа по трубопроводам.
Если внешняя работа не совершается, а трением можно пренебречь, то  (5.12) В условиях, когда движения нет, то р₁=р₂, т.е. всё тепло идёт на изменение энтальпии газа
(5.12) В условиях, когда движения нет, то р₁=р₂, т.е. всё тепло идёт на изменение энтальпии газа  (5.13).
(5.13).
|
|
|
Закон Майера

| 1кг |
| 1кг |
Рассмотрим 1кг рабочего тела при р=const и V=const.
В условиях постоянного объёма 
 (а)
(а)
В условиях постоянного давления  (б)
(б)  (в) величина подведённого тепла при р=соnst
(в) величина подведённого тепла при р=соnst  (г)
(г)
Подставим в (б) значения из (г), (а), (в)

При изменении температуры на 1 градус  или
или  (5.14)
(5.14)
(5.14) носит название закона Майера.
Из уравнения (5.14) видно, что изобарная теплоёмкость больше изохорной теплоёмкости на величину удельной газовой постоянной. Т.к. R не зависит от параметров состояния, то теплоёмкость идеального газа не зависит от давления и объёма, а лишь от температуры.
Умножив (5.14) на молярную массу μ получим  (5.15)
(5.15)
Разность молярных удельных теплоём  таже.
таже.
Рассмотрим отношение удельных массовых теплоёмкостей, называемое показателем адиабаты  к>1 (5.16)
к>1 (5.16)
Решим совместно (5.14) и (5.16) получим 


В большинстве случаев показатель адиабаты определяется природой газа и не зависит от температуры:
–для одноатомных газов к=1,67 –для 2-х атомных газов к=1.4 –для 3-х и многоатомных к=1,28.
 2018-02-13
2018-02-13 624
624








