Это последний комплекс дыхательной цепи, передающий электроны от цитохрома с на молекулярный кислород, окисляя его до Н2О. Цитохромоксидаза - это большой фермент (масса 240 кДа) внутренней мембраны митохондрий, состоящий из 13 субъединиц у млекопитающих, и 3 или 4 - у бактерий. Функциональное ядро содержит четыре редокс-центра: два гемма а -типа (гемм а и гемм а3) (рис. 20) и два атома меди (CuA и CuB) (рис.21).
10 регуляторных субъединиц комплекса кодируются ядерным геномом и синтезируются в цитоплазме: IV (17 кДа), V (12,5 кДа), VIa (10,5 кДа), VIb (9,5 кДа), VIc (8,5 кДа), VII (10 кДа), VIIIa (5,5 кДа), VIIIb (5 кДа), VIIIc (6 кДа).
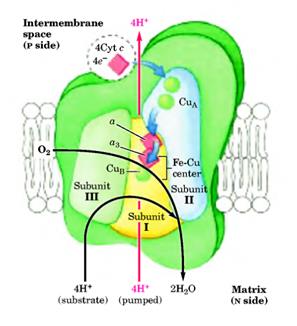
Рисунок 21: Комплекс IV.
Три субъединицы этого комплекса кодируются митохондриальным геномом. Субъединица III (30 кДа) 7 раз пересекает мембрану. Субъединица II (26 кДа) содержит CuA-центр, состоящий из двух ионов Cu в комплексе с –SH группами двух Cys (похож на 2Fe-2S-центр). Кроме того, в субъединице II находятся две гидрофобные последовательности, два раза пересекающие мембрану. Субъединица I (57 кДа) содержит остальные редокс-центры, как-то: две группы геммов а и а3 и CuB-центр. Гемм а3 и CuB формируют второй двуядерный центр, который принимает электроны с гемма а и передает их на О2, связанный с геммом а3. Таким образом, электрон с цитохрома с передается на CuA-центр, далее на гемм а, а после на гемм а3 - CuB –центр. С CuB – а3 – центра электрон переноситься на кислород. Ингибиторами этой реакции являются KCN, CO, H2S и азид.
|
|
|

На каждые четыре электрона, проходящие через комплекс, фермент принимает четыре субстратные Н+ из матрикса (N-side) для восстановления О2 в Н2О. Так же фермент использует энергию этой реакции для переноса через мембрану в межмембранное пространство одного Н+ на каждый перенесенный электрон.
Суммарная реакция, катализируемая цитохромоксидазой:
4 Cyt c (red) + 8 Н+N + О2 →4 Cyt c (ox) + 4 Н+p + Н2О
Это четырехэлектронное восстановление О2 затрагивает редокс центры, которые несут только по одному электрону, что вызывает образование интермидиатов (перекиси водорода и гидроксильного радикала), которые связываются комплексом до образования воды.
В итоге, на каждую пару электронов, переносимую на молекулу О2 приходиться четыре Н+, выкаченных комплексом I, четыре – комплексом III и два – комплексом IV (рис. 22).
Векторное уравнение этого процесса можно записать следующим образом:
NADH + 11 Н+N + 1/2О2 → NAD+ + 10 Н+p + Н2О
Таким образом, перенос двух электронов от NADH к О2 сопровождается переносом через мембрану 10 Н+, в результате чего протоны в межмембранном пространстве накапливаются, создавая протонный градиент. Н+-АТФ-синтаза – фермент, катализирующий фосфорилирование АДФ неорганическим фосфатом с образование АТФ за счет электрохимическая энергия протонного градиента Δμ Н. Синтез АТФ сопряжен с обратным потоком протонов из межмембранного пространства в матрикс.
|
|
|
Н+-АТФ-синтаза
Первой была открыта и изучена бактериальная Н+АТФ-синтаза, митохондриальная Н+АТФ-синтаза имеет аналогичное строение.
Н+-транслоцирующая АТФ-синтаза E.coli состоит из двух субкомплексов: встроенного в мембрану протонного канала (F0) и каталитической субъединицы (F1), выступающей в матрикс (рис.23). Фактор F0 состоит из трех типов субъединиц (а (30 кДа), b (17 кДа), с (8 кДа)), а фактор F1-из пяти (α (55 кДа), β (50 кДа), γ (31,5 кДа), δ (19,5 кДа), ε (15 кДа)) (рис. 25). Так, «головка» каталитической части образована тремя α- и тремя β- субъединицами, между которыми расположены три активных центра. "Ствол" структуры образуют полипептиды F0-части и γ-, δ- и ε-субъединиц головки.
Митохондриальная Н+АТФ-синтаза гомологична бактериальной, но несколько тяжелее и сложнее устроена. Так, в Н+АТФ-синтазе митохондрий присутствуют пять полипептидов, которые отсутствуют у бактерий: ε-субъединица фактора F1 (5,5 кДа), субъединица AL6 фактора F0 (22 кДа), фактор F6 (9 кДа), белковый ингибитор фактора F1 (9,5 кДа), субъединица правильного связывания F1 с F0 (18,5 кДа). Белок OSCP – это белок, обусловливающий чувствительность к олигомицину. Он необходим для правильного связывания F1 с F0. Крупные α- и β- субъединицы очень консервативны (70% сходства), а белок OSCP гомологичен частям δ- и b- субъединиц E.coli, субъединица 9 гомологична субъединице с E.coli.
У животных и дрожжей все субъединицы фактора F1 кодируются ядерным геномом и синтезируются в цитоплазме; у растений, α-субъединица закодирована в мтДНК, а β- субъединица – в ядре, другие сведения отсутствуют.
Н+АТФ-синтаза – это очень массивный белковый комплекс, локализованный во внутренней мембране митохондрий. Н+АТФ-синтаза сильно выдается своей каталитической частью (фактором F1) в матрикс митохондрии. Каталитический цикл (рис.26) подразделяется на три фазы, каждая из которых проходит поочередно в трех активных центрах. Вначале происходит связывание АДФ и Фн (1), затем образуется фосфоангидридная связь (2) и, наконец, освобождается конечный продукт реакции – АТФ (3). При каждом переносе протона через белковый канал F0, в матрикс все три активных центра катализируют очередную стадию реакции.
Согласно хемиосмотической концепции, движение электронов по дыхательной цепи является источником энергии для транслокации протонов через митохондриальную мембрану. Возникающая при этом разность электрохимических потенциалов (ΔμH+) приводит в действие АТФ-синтазу, катализирующую реакцию АДФ+ Фн D АТФ.
В дыхательной цепи есть только 3 участка, где перенос электронов сопряжен с накоплением энергии, достаточным для образованияАТФ, на других этапах возникающая разность потенциалов для этого процесса недостаточна. Максимальная величина коэффициента фосфорилирования, таким образом, составляет 3, если реакция окисления идет с участием НАД+, и 2, если окисление субстрата протекает через флавиновые дегидрогеназы. Теоретически еще одну молекулу АТФ можно получить в трансгидрогеназной реакции (если процесс начинается с восстановленного НАДФ):
НАДФН + НАД+ D НАДФ+ + НАДН + 30 кДж/моль.
Обычно в тканях восстановленный НАДФ используется в пластическом обмене, обеспечивая разнообразные синтетические процессы, так что равновесие трансгидрогеназной реакции сильно сдвинуто влево.
Эффективность окислительного фосфорилирования в митохондриях определяется как отношение величины образовавшегося АТФ к поглощенному кислороду: АТФ/О или Р/О (коэффициент фосфорилирования). Экспериментально определяемые значения Р/О, как правило, оказываются меньше 3. Это свидетельствует о том, что процесс дыхания не полностью сопряжен с фосфорилированием. Действительно, окислительное фосфорилирование, в отличие от субстратного, не является процессом, в котором окисление жестко сопряжено с образованием макроэргов. Степень сопряжения зависит главным образом от целостности митохондриальной мембраны, сберегающей разность потенциалов, создаваемую транспортом электронов. По этой причине соединения, обеспечивающие протонную проводимость (например, 2,4-ди-нитрофенол), являются разобщителями.
|
|
|
В норме скорость митохондриального транспорта электронов регулируется содержанием АДФ. Выполнение клеткой функций с затратой АТФ приводит к накоплению АДФ, который в свою очередь активирует тканевое дыхание. Таким образом, клетки реагируют на интенсивность клеточного метаболизма и поддерживают запасы АТФ на необходимом уровне, т.е. осуществляют дыхательный контроль.
За сутки человек потребляет около 550 л (24,75 моля) кислорода. Если считать, что в тканевом дыхании за этот период восстанавливается 40 г атомов кислорода (20 молей), а величину Р/О принять за 2,5, то в митохондриях должно синтезироваться 100 молей, или около 50 кг АТФ! При этом часть энергии окисления субстратов расходуется на совершение полезной работы, не превращаясь в АТФ.
В дыхательной цепи электроны не всегда достигают места назначения – нередко они выпа-дают из цепи, образуя активные формы кислорода (АФК), концентрация которых в матриксе в 5-10 раз превышает содержание оных в цитоплазме. Что же собой представляют АФК?
 2020-01-14
2020-01-14 676
676








