Федеральное агентство по образованию Российской Федерации
Новокузнецкий филиал-институт государственного образовательного учреждения высшего профессионального образования
«Кемеровский государственный университет»
Кафедра экономики
КУРСОВАЯ РАБОТА
ПО КУРСУ «ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОГРЕССИВНЫХ ТЕХНОЛОГИЙ»
Энергия, энтропия, энергетика. Идеи И. Пригожина и их значение для современной науки
Новокузнецк 2009
Реферат
Энергия, энтропия и энергетика. Идеи И. Пригожина и их значение для современной науки, специальность ЭПЗ-07, Новокузнецк, 2009 г., курсовая работа, пояснительная записка 26 стр., 8 источников, 1 приложение.
ЭНЕРГИЯ, ПОНЯТИЕ ЭНТРОПИИ, СТАТИСТИЧЕСКИЙ СМЫСЛ ПОНЯТИЯ ЭНТРОПИИ, ТЕРМОДИНАМИКА И ЭНТРОПИЯ, ТЕРМОДИНАМИКА НЕРАВНОВЕСНЫХ ПРОЦЕССОВ И ЭНТРОПИЯ, ЭНЕРГЕТИКА, ЭЛЕКТРОЭНЕРГЕТИКА, ТЕПЛОЭНЕРГЕТИКА, ЯДЕРНАЯ ЭНЕРГЕТИКА, ГИДРОЭНЕРГЕТИКА, ИДЕИ И. ПРИГОЖИНА И ИХ ЗНАЧЕНИЕ ДЛЯ СОВРЕМЕННОЙ НАУКИ
Объектом исследования является энергия, энергетика и энтропия.
|
|
|
Предмет исследования – виды энергетики, формы энергии, энтропия в термодинамике и термодинамике неравновесных процессов, исследования И. Пигожина.
Цель работы – выявить значение энергии, энтропии и энергетики. Рассмотреть идеи И. Пригожина и обозначить их значение для современной науки
В процессе работы были изучены теоретические аспекты энтропии, энергии и энергетики, рассмотрены виды энергетики и энтропии.
В результате исследования была выявлена роль энергии, энтропии и энергетики в физических процессах и науке; значение идей И. Пригожина.
Содержание
ВВЕДЕНИЕ
Энергия
Понятие энтропии. Статистический смысл понятия энтропии
Термодинамика и энтропия
Термодинамика неравновесных процессов и энтропия
Энергетика
Электроэнергетика
Теплоэнергетика
Ядерная энергетика
Гидроэнергетика
Идеи И. Пригожина и их значение для современной науки
ЗАКЛЮЧЕНИЕ
СПИСОК ЛИТЕРАТУРЫ
ПРИЛОЖЕНИЕ
Введение
Предметом работы является энергия, энтропия и энергетика. Целью данной работы является изучение энтропии, энергии, энергетики; рассмотрение равновесия в живой природе и изучение идей И. Пригожина. Поставленная цель, ставит решение следующих задач: рассмотрения понятия энтропии, энергии, энергетики статистического смысла данного понятия, энтропии как меры степени неопределенности; ознакомление с видами энергии и энергетики; изучение идей И. Пригожина и выявить их значение для современной науки.
Данная тема актуальна, так как трудно найти понятия более общие для всех наук (не только естественных) и, вместе с тем, иногда носящих оттенок загадочности, чем энтропия, энергия и энергетика. Энергия - не только одно из чаще всего обсуждаемых сегодня понятий; помимо своего основного физического (а в более широком смысле - естественнонаучного) содержания, оно имеет многочисленные экономические, технические, политические и иные аспекты.
|
|
|
Человечеству нужна энергия, причем потребности в ней увеличиваются с каждым годом. Вместе с тем запасы традиционных природных топлив (нефти, угля, газа и др.) конечны. Конечны также и запасы ядерного топлива - урана и тория, из которого можно получать в реакторах-размножителях плутоний. Практически неисчерпаемы запасы термоядерного топлива - водорода, однако управляемые термоядерные реакции пока не освоены и неизвестно, когда они будут использованы для промышленного получения энергии в чистом виде, т.е. без участия в этом процессе реакторов деления. Остаются два пути: строгая экономия при расходовании энергоресурсов и использование нетрадиционных возобновляемых источников энергии.
Отчасти это связано с самими названиями. Если бы не звучное название “энтропия” осталась бы с момента первого рождения всего лишь “интегралом Клаузиуса”, вряд ли она бы не рождалась вновь и вновь в разных областях науки под одним именем. Кроме того, ее первооткрыватель Клаузиузус, первым же положил начало применению введенного им для, казалось бы узкоспециальных термодинамических целей понятия к глобальным космологическим проблемам (тепловая смерть Вселенной). С тех пор энтропия многократно фигурировала в оставшихся навсегда знаменитыми спорах. В настоящее время универсальный характер этого понятия общепризнан и она плодотворно используется во многих областях.
Энергия
Энергия (от греч. enйrgeia — действие, деятельность), общая количественная мера движения и взаимодействия всех видов материи. Вследствие существования закона сохранения энергии понятие энергии связывает воедино все явления природы. Энергия в природе не возникает из ничего и не исчезает; она только может переходить из одной формы в другую. В соответствии с различными формами движения материи рассматривают различные формы энергии: механическую, электромагнитную, ядерную и др. Это подразделение до известной степени условно. Так, химическая энергия складывается из кинетической энергии движения электронов и электрической энергии взаимодействия электронов друг с другом и с атомными ядрами. Внутренняя энергия равна сумме кинетической энергии хаотического движения молекул относительно центра масс тел и потенциальных энергии взаимодействия молекул друг с другом. Энергия системы однозначно зависит от параметров, характеризующих состояние системы. В случае непрерывной среды или поля вводятся понятия плотности энергии, т. е. энергия в единице объема, и плотности потока энергии, равной произведению плотности энергии на скорость ее перемещения.
В относительности теории показывается, что энергия тела Е неразрывно связана с его массой Т соотношением Е = Тс2, где с — скорость света в вакууме. Согласно классической физике, энергия любой системы меняется непрерывно и может принимать любые значения. Согласно квантовой теории, энергия микрочастиц, движение которых происходит в ограниченной области пространства (например, электронов в атомах), принимает дискретный ряд значений. Атомы излучают электромагнитную энергию в виде дискретных порций — световых квантов, или фотонов.
Энергия измеряется в тех же единицах, что и работа: в системе СГС — в эргах, в Международной системе единиц (СИ) — в джоулях; в атомной и ядерной физике и в физике элементарных частиц обычно применяется внесистемная единица — электрон-вольт. [1, 32-34]
|
|
|
Понятие энтропии. Статистический смысл понятия энтропии
Энтропия (от греч. entropia - поворот, превращение) - мера неупорядоченности больших систем. Впервые понятие "энтропия" введено в XIX в. в результате анализа работы тепловых машин, где энтропия характеризует ту часть энергии, которая рассеивается в пространстве, не совершая полезной работы (отсюда определение: энтропия - мера обесценивания энергии). Затем было установлено, что энтропия характеризует вероятность определенного состояния любой физической системы среди множества возможных ее состояний. В закрытых физических системах все самопроизвольные процессы направлены к достижению более вероятных состояний, т. е. к максимуму энтропии. В равновесном состоянии, когда этот максимум достигается, никакие направленные процессы невозможны. Отсюда возникла гипотеза о тепловой смерти Вселенной. Однако распространение на всю Вселенную законов, установленных для закрытых систем, не имеет убедительных научных оснований. В XX в. понятие " энтропия " оказалось плодотворным для исследования биосистем, а также процессов передачи и обработки информации. Эволюция в целом и развитие каждого организма происходит благодаря тому, что биосистемы, будучи открытыми, питаются энергией из окружающего мира. Но при этом биопроцессы протекают таким образом, что связанные с ними "производство энтропии " минимально. Это служит важным руководящим принципом и при разработке современных технологических процессов, при проектировании технических систем. Количественная мера информации формально совпадает с "отрицательно определенной " энтропией. Но глубокое понимание соответствия энтропии физической и информационной остается одной из кардинальных недостаточно исследованных проблем современной науки. Ее решение послужит одним из важных факторов становления нового научно-технического мышления.[2, 48-49]
Энтропия широко применяется и в других областях науки: в статистической физике как мера вероятности осуществления какого-либо макроскопического состояния; в теории информации как мера неопределенности какого-либо опыта (испытания), который может иметь разные исходы. Эти трактовки имеют глубокую внутреннюю связь. Например, на основе представлений об информационной энтропии можно вывести все важнейшие положения статистической физики.
|
|
|
Понятие энтропия, как показал впервые энтропию Шрёдингер (1944), существенно и для понимания явлений жизни. Живой организм с точки зрения протекающих в нём физико-химических процессов можно рассматривать как сложную открытую систему, находящуюся в неравновесном, но стационарном состоянии. Для организмов характерна сбалансированность процессов, ведущих к росту энтропии, и процессов обмена, уменьшающих её. Однако жизнь не сводится к простой совокупности физико-химических процессов, ей свойственны сложные процессы саморегулирования. Поэтому с помощью понятия энтропии нельзя охарактеризовать жизнедеятельность организмов в целом.
Энтропия, характеризуя вероятность осуществления данного состояния системы, согласно (1) является мерой его неупорядоченности. Изменение энтропии DS обусловлено как изменением р, V и Т, так и процессами, протекающими при р, Т = const и связанными с превращением веществ, включая изменение их агрегатного состояния, растворение и химическое взаимодействие.
Изотермическое сжатие вещества приводит к уменьшению, а изотермическое расширение и нагревание - к увеличению его Энтропия, что соответствует уравнениям, вытекающим из первого и второго начал термодинамики:
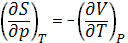 (1);
(1);
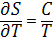 (3)
(3)
В соответствии с (3) энтропия измеряется в кал/(моль· К) (энтропийная единица - э. е.) и дж/(моль·К). При расчётах обычно применяют значения Энтропия в стандартном состоянии, чаще всего при 298,15 К (25 °С), т. е. S0298.
Энтропия увеличивается при переходе вещества в состояние с большей энергией. D S сублимации > DS парообразования >> DS плавления >DS полиморфного превращения. Например, энтропия воды в кристаллическом состоянии равна 11,5, в жидком - 16,75, в газообразном - 45,11 э. е.
Чем выше твёрдость вещества, тем меньше его энтропия; так, энтропия алмаза (0,57 э. е.) вдвое меньше энтропии графита (1,37 э. е.). Карбиды, бориды и другие очень твёрдые вещества характеризуются небольшой Энтропия аморфного тела несколько больше энтропии кристаллического. Возрастание степени дисперсности системы также приводит к некоторому увеличению её энтропии.
Энтропия возрастает по мере усложнения молекулы вещества; так, для газов N2О, N2O3 и N2O5 Энтропия составляет соответственно 52,6; 73,4 и 85,0 э. е. При одной и той же молекулярной массе энтропия разветвленных углеводородов меньше энтропии неразветвлённых; энтропия циклоалкана (циклана) меньше энтропии соответствующего ему алкена.
Энтропия простых веществ и соединений (например, хлоридов ACIn), а также её изменения при плавлении и парообразовании являются периодическими функциями порядкового номера соответствующего элемента. Периодичность изменения энтропии для сходных химических реакций типа 1/n Акрист + 1/2Сl2газ = 1/n ACln крист практически не проявляется. В совокупности веществ-аналогов, например АСl4газ (А - С, Si, Ge, Sn, Pb) энтропия изменяется закономерно. Сходство веществ (N2 и СО; CdCl2 и ZnCl2; Ag2Se и Ag2Te; ВаСОз и BaSiO3; PbWO4 и РЬМоО4) проявляется в близости их энтропии. Выявление закономерности изменения энтропии в рядах подобных веществ, обусловленного различиями в их строении и составе, позволило разработать методы приближённого расчёта энтропии.
Знак изменения энтропии при химической реакции DS х. р. определяется знаком изменения объёма системы DV х. р.; однако возможны процессы (изомеризация, циклизация), в которых DS х. р. № 0, хотя DV х. р.» 0. В соответствии с уравнением DG = DН - ТDS (G - гиббсова энергия, Н - энтальпия) знак и абсолютное значение DS х. р. важны для суждения о влиянии температуры на равновесие химическое. Возможны самопроизвольные экзотермические. процессы (DG < 0, DH < 0), протекающие с уменьшением энтропии (DS < 0). Такие процессы распространены, в частности, при растворении (например, комплексообразование), что свидетельствует о важности химических взаимодействий между участвующими в них веществами.[3, 157-163]
Термодинамика и энтропия.
Так, для термодинамической системы, совершающей квазистатический (бесконечно медленно) циклический процесс, в котором система последовательно получает малые количества теплоты dQ при соответствующих значениях абсолютной температуры Т, интеграл от «приведенного» количества теплоты dQ/ Т по всему циклу равен нулю
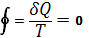 т.н. равенство Клаузиуса
т.н. равенство Клаузиуса
Это равенство, эквивалентное второму началу термодинамики для равновесных процессов, Клаузиус получил, рассматривая произвольный циклический процесс как сумму очень большого, в пределе бесконечного, числа элементарных обратимых Карно циклов. Математически равенство Клаузиуса необходимо и достаточно для того, чтобы выражение
dS = dQ/T (1)
представляло собой полный дифференциал функции состояния S, названное «энтропия» (дифференциальное определение энтропии). Разность энтропии системы в двух произвольных состояниях А и В (заданных, например, значениями температур и объемов) равна
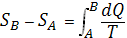 (2)
(2)
(интегральное определение энтропии). Интегрирование здесь ведется вдоль пути любого квазистатического процесса, связывающего состояния А и В, при этом, согласно равенству Клаузиуса, приращение энтропии DS = SB - SA не зависит от пути интегрирования.
Т. о., из второго начала термодинамики следует, что существует однозначная функция состояния S, которая при квазистатических адиабатных процессах (dQ = 0) остаётся постоянной. Процессы, в которых энтропия остаётся постоянной, называются изоэнтропийными. Примером может служить процесс, широко используемый для получения низких температур, - адиабатное размагничивание. При изотермических процессах изменение энтропии равно отношению сообщенной системе теплоты к абсолютной температуре. Например, изменение энтропии при испарении жидкости равно отношению теплоты испарения к температуре испарения при условии равновесия жидкости с её насыщенным паром.
Согласно первому началу термодинамики (закону сохранения энергии), dQ = dU+pdV, т. е. сообщаемое системе количество теплоты равно сумме приращения внутренней энергии dU и совершаемой системой работы pdV, где р - давление, V - объём системы. С учётом первого начала термодинамики дифференциальное определение энтропии принимает вид
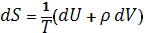 (3)
(3)
откуда следует, что при выборе в качестве независимых переменных внутренней энергии U и объёма V частные производные Энтропия связаны с абсолютной температурой и давлением соотношениями:
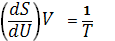 (4) и
(4) и 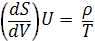 (5)
(5)
Эти выражения представляют собой уравнения состояния системы (первое - калорическое, второе - термическое). Уравнение (4) лежит в основе определения абсолютной температуры.
Формула (2) определяет энтропию лишь с точностью до аддитивной постоянной (т. е. оставляет начало отсчёта энтропии произвольным). Абсолютное значение энтропии позволяет установить третье начало термодинамики, или Нернста теорему: при стремлении абсолютной температуры к нулю разность DS для любого вещества стремится к нулю независимо от внешних параметров. Поэтому: энтропия всех веществ при абсолютном нуле температуры можно принять равной нулю (эту формулировку теоремы Нернста предложил в 1911 М. Планк). Основываясь на ней, за начальную точку отсчёта энтропии принимают 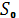 = 0 при Т = 0.
= 0 при Т = 0.
Важность понятия энтропии для анализа необратимых (неравновесных) процессов: также была показана впервые Клаузиусом. Для необратимых процессов интеграл от приведённой теплоты dQ / Т по замкнутому пути всегда отрицателен
(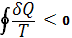 , т. н. неравенство Клаузиуса).
, т. н. неравенство Клаузиуса).
Это неравенство - следствие теоремы Карно: кпд частично или полностью необратимого циклического процесса всегда меньше, чем кпд обратимого цикла. Из неравенства Клаузиуса вытекает, что
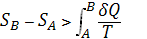 6)
6)
поэтому энтропия адиабатически изолированной системы при необратимых процессах может только возрастать.
Т. о., энтропия определяет характер процессов в адиабатической системе: возможны только такие процессы, при которых энтропия либо остаётся неизменной (обратимые процессы), либо возрастает (необратимые процессы). При этом не обязательно, чтобы возрастала энтропия каждого из тел, участвующего в процессе. Увеличивается общая сумма энтропии тел, в которых процесс вызвал изменения.
 2020-01-14
2020-01-14 187
187







