Никель-кадмиевые (НК) аккумуляторы по сравнению с НЖ обладают лучшей работоспособностью в условиях повышенной токовой нагрузки и пониженной температуры, а также малым саморазрядом. Ламельные НК аккумуляторы, аналогичные по устройству НЖ, применяют в составе тяговых и других батарей.
В 1950 г. появились промышленные образцы герметичных НК аккумуляторов. За последнее время аккумуляторы этого типа получили широкое распространение.
Преимущества:
- отсутствие выделения электролита и газов,
- исключение контроля и корректировки электролита,
- работа в любом положении,
- способность выдерживать форсированный заряд и разряд,
- нечувствительность к перезаряду,
- стабильность разрядных характеристик в широком токовом интервале,
- возможность эксплуатации в диапазоне температуры от –40 до +50 °С.
Недостаток НК аккумуляторов —высокая стоимость, связанная с трудоемкой технологией и с дефицитностью кадмия и никеля.
Реакции в никель-кадмиевом аккумуляторе
|
|
|
Электрохимическая система Cd | KOH | NiOOH.
Суммарная реакция при разряде
2NiOOH + Cd + 2Н2О  2Ni(ОН)2 + Cd(OH)2
2Ni(ОН)2 + Cd(OH)2
Реакции на положительном электроде аналогичны для реакций в НЖ аккумуляторах..
Реакции на кадмиевом электроде
Разряд
На первой стадии разряда происходит окисление кадмия до гидроксида, причем этому предшествует образование адсорбированного гидрокомплекса:
Cd + OH– ↔ CdOHадс
CdОН–адс + OH–  Cd(OH)2 + 2е– E0 = 0,809 В (9.1)
Cd(OH)2 + 2е– E0 = 0,809 В (9.1)
Наряду с устойчивой β-модификацией образуется активная неустойчивая модификация α-Cd(OH)2, которая, по-видимому, определяет скорость растворения гидроксида с образованием кадматного комплекса:
Cd(ОН)2 + 2OН–  [Cd(ОН)4]2–
[Cd(ОН)4]2–
Растворимость тетрагидроксокадмата калия относительно невелика и составляет 1,3∙10–4 моль/л, однако фактическая концентрация значительно выше из-за пересыщения приэлектродного слоя. В результате происходит распад кадмат-иона по реакции
[Cd(ОН)4]2– 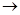 β-Cd(OH)2 + 2ОН–
β-Cd(OH)2 + 2ОН–
Пассивацию кадмиевого электрода связывают с торможением переноса OH–-ионов сквозь пористый слой β-Cd(OH)2. Существуют и иные представления о пассивации кадмия; так, некоторое значение придают оксиду кадмия, предположительно блокирующему электродную поверхность.
Как и в случае железного электрода, пассивация кадмия усиливается по мере роста разрядного тока и снижения температуры. Область активного растворения кадмиевой губки по этим параметрам значительно шире и, кроме того, сильно зависит от конструкции и технологии изготовления отрицательного электрода.
Заряд
При заряде первичной является реакция восстановления тетрагидроксокадмат-иона до кадмия, убыль концентрации которого непрерывно компенсируется растворением гидроксида кадмия. Перенапряжение электродной реакции невелико. Поскольку перенапряжение реакции выделения водорода на кадмии значительно, а равновесный потенциал водородного электрода отрицательнее равновесного потенциала кадмиевого электрода, заряд протекает эффективно со 100%-ным выходом по току. Только после сообщения электроду около 80% зарядной емкости начинается побочная реакция выделения водорода.
|
|
|
На рис. 9.1 (кривая 1) показан подъем напряжения и горизонтальный верхний участок, отвечающий реакции восстановления воды до водорода.

Рис. 9.1. Изменение напряжения при заряде негерметичного (1) и герметичного (2) НК аккумулятора
Кадмиевый электрод в герметичном аккумуляторе.
Одним из условий герметизации является осуществление замкнутого кислородного цикла. Сущность его в том, что кислород, образующийся при заряде на положительном электроде по реакции
4OН– 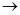 O2 + 2Н2O + 4е–
O2 + 2Н2O + 4е–
способен восстанавливаться на кадмии до ОН–-ионов. Процесс протекает в режиме работы газодиффузионного электрода при соблюдении определенных условий. Использование тонкослойного матричного электролита позволяет наиболее эффективно осуществлять транспорт кислорода к электродной поверхности. Определенное соотношение структурных характеристик сепаратора и кадмиевого электрода дает возможность обеспечить ту газонаполненность пор, которая отвечает оптимальным условиям ионизации кислорода.
По мере повышения скорости реакции восстановления кислорода
О2 + 2Н2О + 4е– 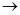 4OН– (9.2)
4OН– (9.2)
которая обычно лимитируется лишь диффузионными ограничениями, снижается скорость реакции заряда
Cd(ОН)2 + 2е– 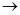 Cd + 2ОН–
Cd + 2ОН–
Поэтому при достижении 100%-ного выхода по току по реакции восстановления кислорода процесс заряда кадмиевого электрода прекращается. Это должно произойти до начала выделения на кадмиевом электроде водорода (рис. 9.1, кривая 2).
Образование Н2 на отрицательном электроде не протекает в том случае, если отрицательная активная масса находится в избытке по отношению к активной массе положительного электрода. На практике этот избыток в расчете на зарядную емкость составляет от 20 до 100%.
Саморазряд кадмиевого электрода с выделением водорода термодинамически невозможен (см. рис. 3.4). Снижение емкости заряженного НК аккумулятора происходит из-за побочной реакции окисления кадмия растворенным в электролите кислородом с образованием плотных плохо растворимых оксидных слоев. Существенный вклад в саморазряд аккумулятора вносит положительный электрод, который снижает емкость с выделением кислорода. На скорость саморазряда влияют примеси в электролите и активных массах, температура, особенности конструкции электродов.
 2020-04-12
2020-04-12 153
153








