Контрольные вопросы
Типы изотермических («давление пара-состав») и изобарных («температура кипения-состав») диаграмм состояния бинарных растворов легколетучих веществ. Определение состава пара и жидкости, находящихся в равновесии. Применение правила фаз Гиббса для анализа диаграмм жидкость-пар. Законы Коновалова. Азеотропные смеси и их свойства. Основы разделения веществ методом фракционной перегонки.
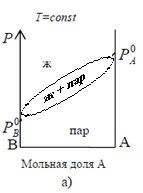
Пусть жидкий раствор состоит из двух летучих компонентов и находится в равновесии со своим паром (рис. 1). В такой системе насыщенный пар содержит оба компонента, причем состав пара обычно отличается от состава жидкого раствора, из которого он получен.
К = 2, Ф = 2, Т = const

| N'А – мольная доля компонента А в паре; N'В – мольная доля компонента В в паре; NА – мольная доля А в жидкости; NВ – мольная доля В в жидкости. |
Рис. 1. Летучая смесь двух компонентов А и В,
находящаяся в равновесии со своим паром при Т = const
При заданной температуре величину давления пара над летучей смесью (Р = РА+ РВ) и его состав (N'А, N'В) для идеальных систем можно рассчитать по закону Рауля, для реальных измерить экспериментально.
|
|
|
Для наглядного изображения фазовых равновесий в системах используется графический метод. Например, в прямоугольной системе координат на оси ординат откладывается температура или давление, а на оси абсцисс – состав системы. Построенные таким способом изображения называют фазовыми диаграммами или диаграммами состояния.
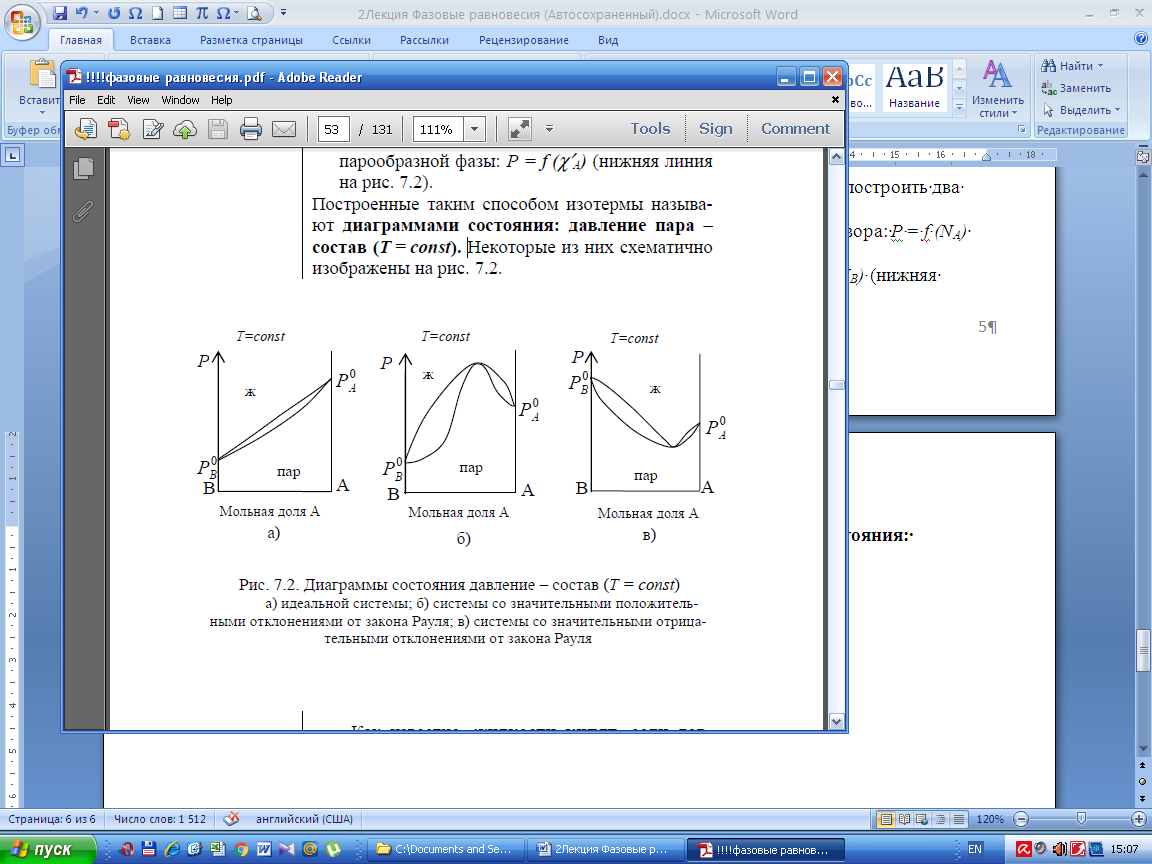
По этим данным в координатах «давление пара–состав фазы» можно построить два графика:
1) зависимость общего давления насыщенного пара от состава жидкого раствора: Р = f (NА) (верхняя линия на рис. 2 - линия жидкости);
2) зависимость общего давления пара от состава парообразной фазы: Р = f (NВ) (нижняя линия на рис. 2 – линия пара).
Область, заключенная между двумя этими линиями называется областью гетерогенного равновесия жидкость – пар.
| 
|
Рис. 2 Диаграммы состояния давление – состав (Т = const):
а) идеальной системы; б) системы со значительными положительными отклонениями от закона Рауля; в) системы со значительными отрицательными отклонениями от закона Рауля
Как известно, жидкости кипят, если давление пара над ними становится равным внешнему давлению. Отсюда следует, что чем выше давление пара над жидкостью, тем ниже ее температура кипения при данном внешнем давлении. При испарении летучей смеси ее состав меняется, поскольку более летучий компонент интенсивнее переходит в парообразную фазу, поэтому летучие смеси кипят не при постоянной температуре, как чистые жидкости, а в некотором интервале температур.
|
|
|
При изучении равновесия жидкий раствор – пар часто применяют диаграммы Ткип– состав (Р=const), называемые диаграммами кипения. Чтобы уметь пользоваться диаграммой кипения, нужно четко представлять, что означает каждая линия и точка диаграммы.
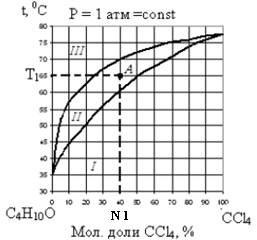
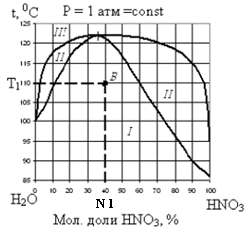
На рис. 3, 4 изображены диаграммы кипения для некоторых бинарных систем, с неограниченной взаимной растворимостью.
| 
|
| Рис. 3 Диаграмма кипения системы ССl4 – C2H5OC2H5 при постоянном давлении | Рис. 4 Диаграмма кипения системы HNO3 – H2O при постоянном давлении |
Нижняя линия на диаграммах кипения описывает зависимость температуры начала кипения (температуры, при которой появляется первый пузырек пара) от состава жидкости, выраженного в массовых или мольных долях одного из компонентов.
Верхняя линия получится, если построить график зависимости температуры начала кипения от состава первого пузырька пара.
Каждой смеси заданного состава (N 1), находящейся при заданной температуре Т1, соответствует на диаграмме определенная, так называемая, «фигуративная» точка (см.точку А на рис. 3 и точку В на рис. 4).
Верхняя и нижняя линии делят диаграмму кипения на три области I, II, III (рис. 3 и 4):
· каждая точка области I соответствует системам, состоящим их одной жидкой фазы (Ф=1);
· каждая точка области II описывает системы, состоящие из двух фаз: жидкого раствора и равновесного с ним пара (Ф=2);
· каждая точка области III соответствует системам, состоящим из одной газообразной фазы (Ф=1).
По диаграмме кипения можно определить фазовый состав системы в любых заданных условиях.
Пример 1: пусть система содержит 60% (мол) СН3СООН, 40%(мол) Н2О и находится при температуре 102°С, такой системе соответствует на диаграмме Н2О – СН3СООН фигуративная точка 1, лежащая в области I (ниже нижней кривой). Это означает, что система представляет собой некипящий жидкий раствор, т.е. система состоит из одной жидкой фазы (рис 5).
 Рис. 5 Диаграмма кипения Н2О – СН3СООН; фигуративная точка 1, характеризующая раствор, лежит ниже нижней линии, жидкий раствор, находящийся при температуре ниже температуры начала кипения. Раствор не кипит, так как внешнее давление выше давления насыщенного пара.
Рис. 5 Диаграмма кипения Н2О – СН3СООН; фигуративная точка 1, характеризующая раствор, лежит ниже нижней линии, жидкий раствор, находящийся при температуре ниже температуры начала кипения. Раствор не кипит, так как внешнее давление выше давления насыщенного пара.
Ф = 1
Пример 2: если заданный раствор нагреть до температуры начала кипения, равной 106°С (рис.6), появится первый пузырек пара, фигуративная точка, описывающая такую систему, лежит на нижней линии (фигуративная точка 2). Система состоит из двух фаз, причем состав жидкой фазы фактически соответствует общему составу смеси: 60% СН3СООН, 40% Н2О, поскольку лишь ничтожное количество вещества перешло в парообразную фазу, а состав пузырька пара отличается от состава жидкости: доля более летучего компонента
(Н2О) в пузырьке пара будет больше, чем в жидкости.
Состав первого пузырька пара можно точно определить по верхней кривой (точка а), которая, является графиком функции, связывающей Тнач.кип и состав первого пузырька. Итак, первый пузырек пара в нашей системе имеет температуру 106°С и содержит 50% СН3СООН и 50% Н2О (рис. 6).

Рис. 6 Диаграмма кипения Н2О – СН3СООН; фигуративная точка 2, характеризующая систему, лежит на нижней линии. Жидкий раствор, находящийся при температуре начала кипения, состоит из жидкой фазы и первого пузырька пара. Давление пара внутри пузырька равно внешнему давлению. Состав пара и жидкости неодинаков. Ф = 2
Пример 3: пусть система, содержащая 60% СН3СООН и 40% Н2О, находится при температуре 107 ° С. Такой системе соответствует на диаграмме кипения (рис. 7) фигуративная точка 3, лежащая в области II (см. рис. 3). Температура системы выше температуры начала кипения, но ниже температуры конца кипения жидкого раствора данного состава; т.е. система должна состоять из двух равновесных фаз: «невыкипевшей» жидкости и насыщенного пара, причем ни в жидкой фазе, ни в паре уже не содержится 60% СН3СООН; пар будет обогащен более летучим компонентом – водой, а в той части системы, которая осталась в жидком состоянии увеличится доля менее летучей уксусной кислоты.
|
|
|
Состав равновесных фаз можно найти по правилу рычага, согласно которому отношение масс жидкости и пара обратно пропорционально отношению длин отрезков, на которые фигуративная точка системы делит прямую (ноду) соединяющую фигуративные точки. Фигуративные точки, изображающие состав всей системы в целом и составы отдельных равновесных фаз, лежат на одной прямой, называемой «нодой».
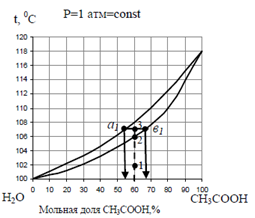 Так система, изображенная на диаграмме СН3СООН – Н2О (рис.7) точкой 3, состоит из двух фаз: жидкой, состав которой соответствует точке «в1» (67% СН3СООН и 33% Н2О), и парообразной, состав которой соответствует точке «а1» (54% СН3СООН и 46% Н2О).
Так система, изображенная на диаграмме СН3СООН – Н2О (рис.7) точкой 3, состоит из двух фаз: жидкой, состав которой соответствует точке «в1» (67% СН3СООН и 33% Н2О), и парообразной, состав которой соответствует точке «а1» (54% СН3СООН и 46% Н2О).
Рис. 7 Диаграмма кипения Н2О – СН3СООН; фигуративная точка 3, характеризующая систему, находится выше нижней, но ниже верхней кривой. Бинарный жидкий раствор, находящийся в равновесии со своим паром при Р =1атм. и t =107°С. Состав равновесного пара отличается от состава жидкости. Ф = 2
Пример 4: температура конца кипенияраствора, содержащего 60% СН3СООН и 40% Н2О, составляет 108 ° С. При этой температуре вся исходная жидкая смесь, кроме последней капли, превращается в пар. Состав пара практически тот же, что и общий состав смеси, поскольку лишь незначительное количество вещества остается в жидкой фазе (см. рис.8). Такой системе соответствует на диаграмме кипения фигуративная точка, лежащая на верхней кривой (точка 4). Последняя капля жидкости по составу будет отличаться от пара: естественно предположить, что доля менее летучего компонента (СН3СООН) в жидкой фазе окажется больше, чем в газообразной.

Рис. 8 Диаграмма кипения Н2О – СН3СООН; фигуративная точка 4, характеризует систему, находящуюся при температуре конца кипения. Система, находящаяся при температуре конца кипения, состоит из пара и последней капли жидкости. Состав пара отличается от состава жидкости
|
|
|
По диаграмме кипения (рис.7) можно легко определить состав последней капли жидкости, для этого в соответствии с правилом соединительной прямой, нужно соединить фигуративную точку 4 горизонтальной прямой с нижней линией: точка «в2» соответствует составу последней капли жидкости; следовательно, последняя капля содержит 71% СН3СООН и 29% Н2О; (доля СН3СООН, как и предполагалось, больше, чем в исходной смеси, где ее доля составляет 60%).
Пример 5: фигуративная точка «5» соответствует системе, содержащей 60% СН3СООН, 40% Н2О и находящейся при температуре 113 ° С, т.е. выше температуры конца кипения жидкости данного состава. В этом случае система состоит только из парообразной фазы, содержащей 60% СН3СООН, 40% Н2О (рис. 9).

Рис. 9 Диаграмма кипения Н2О – СН3СООН; фигуративная точка 5, характеризующая систему, лежит выше верхней линии. Cистема, находящаяся выше температуры конца кипения, состоит из одной газообразной фазы. Ф = 1
Для летучих смесей, находящихся в равновесии со своим паром, выполняются законы Коновалова.
 2020-05-21
2020-05-21 6062
6062