Согласно первому закону Коновалова: пар по сравнению с жидким раствором, находящимся с ним в равновесии, обогащен тем компонентом, прибавление которого к
Раствору понижает температуру кипения раствора при заданном постоянном давлении.
Например, рис. 10, при Р=1атм и t = 110°C в системе Н2О – СН3СООН равновесие устанавливается, если в жидкой фазе N СН 3 СООН = 80%, N Н 2 О = 20%, а в паре N СН 3 СООН = 70%, N Н 2 О = 30%, т.е. доля Н2О в паре больше, чем в жидкости (пар обогащен Н2О). Это согласуется с первым законом Коновалова. Действительно из рис. 10 следует, если к жидкому раствору добавить некоторое количество воды, состав системы изменится, фигуративная точка, описывающая систему, сдвинется влево (точка в 1), температура начала кипения понизится.
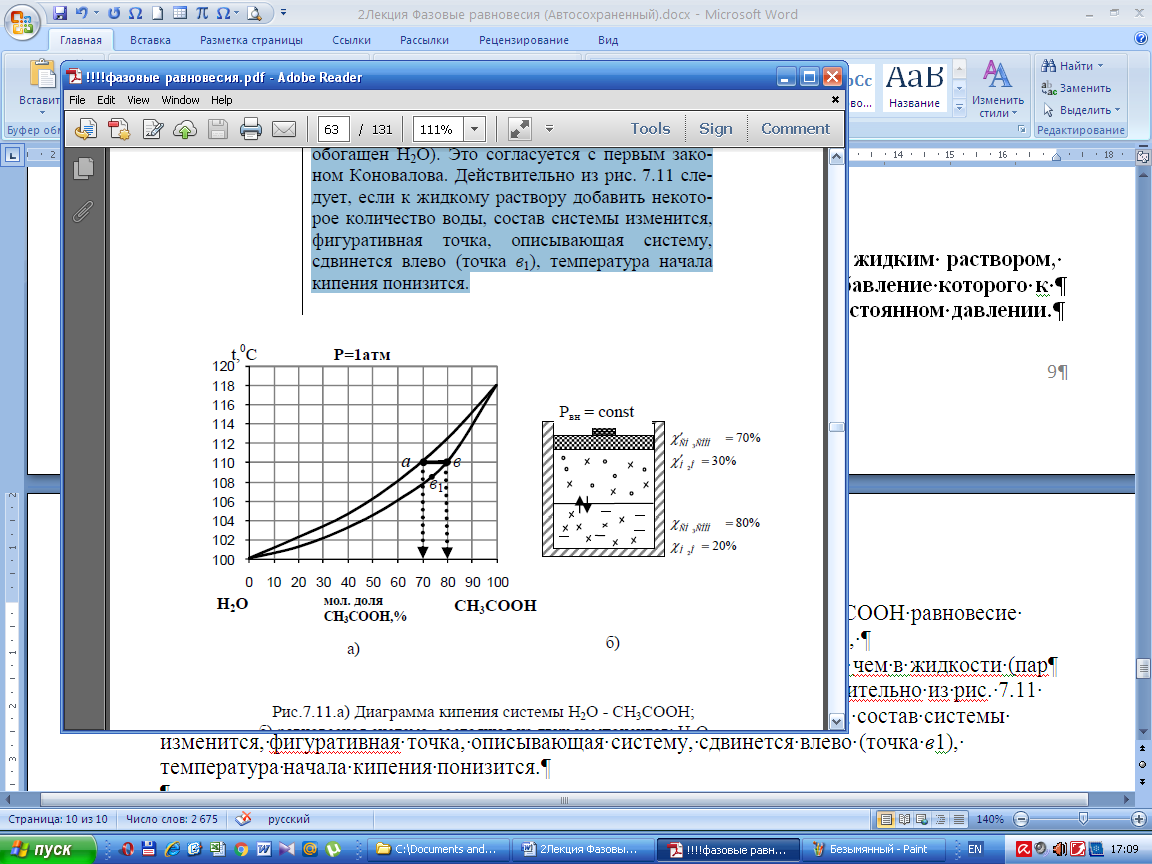
Рис.10 Диаграмма кипения системы Н2О - СН3СООН, равновесная система, состоящая из двух компонентов: Н2О и СН3СООН, находящаяся при 110 0С и Р = 1атм
Азеотропные смеси.
 2020-05-21
2020-05-21 721
721








