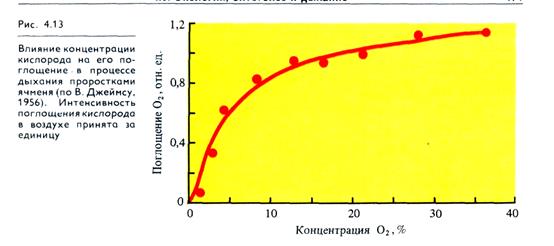
Концентрация О2. Процесс дыхания связан с непрерывным потреблением кислорода клетками и тканями растений. В то же время окислительные превращения субстратов при дыхании включают не только аэробные, но и анаэробные процессы (гликолиз, брожение). Поэтому интересен тот факт, что при снижении парциального давления О2 с 21 до 9% интенсивность дыхания тканей растений меняется незначительно (рис. 4.13). При 5% О2 у молодых растений начинает несколько снижаться поглощение О2 и в меньшей степени изменяется выделение СО2. Как отмечалось, одна из важнейших конечных оксидаз аэробного дыхания — цитохромоксидаза — обладает высоким сродством к кислороду и может функционировать при его низких парциальных давлениях.
Эти факты можно объяснить как тем, что в эволюции дыхательные системы растений формировались в низкокислородных условиях, так и тем, что возможность функционирования аэробной дыхательной цепи при низких парциальных давлениях О2 — один из важных адаптивных признаков, элемент надежности энергетики растения. Это тем более важно, что газовый состав внутренних тканей органов растений может отличаться от атмосферного. Так, в листовой паренхиме сахарной свеклы содержание О2 меняется в течение суток от 7,1 до 17,4%, а СО2 - от 0,9 до 5,1%; в мякоти зрелых яблок содержится 7,5 СО2 и 13,9% О2, а плодов лимона - 8,5 СО2 и 11,5% О2.
У растений, обитающих в условиях систематического затопления (болотные и др.), существует ряд приспособлений к перенесению недостатка кислорода: развитие аэренхимы, способность использовать кислород нитратов («нитратное» дыхание), различные способы устранения избытка продуктов брожения (этанола, молочной кислоты), а также механизмы их использования на нужды обмена веществ.
Избыток кислорода в тканях растений может возникать лишь локально. В атмосфере чистого кислорода дыхание растений снижается, а при длительном его действии растение погибает. Эффект избытка О2 связан с усилением в клетках свободнорадикальных реакций, повреждением мембран вследствие окисления их липидов и в конечном итоге — с нарушением многих процессов обмена веществ.
Диоксид углерода. Повышение концентрации СО2 как конечного продукта дыхания приводит к снижению интенсивности дыхания. При повышении концентрации СО2 тормозятся реакции декарбоксилирования и активность сукцинатде-гидрогеназы и, следовательно, уменьшаются выделение СО2 и дыхательный коэффициент. При этом наблюдается закисле-ние тканей — ацидоз, что может приводить к вредным последствиям. СО2 хорошо растворяется в липидах и таким образом может воздействовать на мембраны. По-видимому, он обладает некоторым наркотическим действием. Предполагается, что СО2 способен регулировать метаболизм растений в анаэробных условиях. У листьев ингибирующее действие высоких концентраций СО2 на дыхание может быть связано с закрыванием устьиц в этих условиях. Повышенное содержание СО2 в тканях семян, покрытых плотной оболочкой,— один из способов поддержания состояния покоя.
Температура. Дыхание, подобно другим ферментативным процессам, зависит от температуры. В определенных температурных границах эта зависимость подчиняется правилу Вант-Гоффа (скорость химических реакций удваивается при повышении температуры на 10 °С). В интервале температур от 0 до 20 °С Q10 дыхания равен 2-3. При температурах выше 20 °С величина Q10 может понижаться. Одна из причин этого — уменьшение растворимости О2 в жидкостях при повышении температуры. Эффект температуры проявляется обычно вместе
с другими факторами. Например, в условиях высокой температуры сильнее подавляется дыхание при пониженном содержании О2 или повышенной концентрации СО2 и т. д.
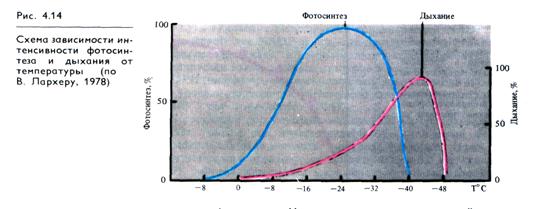
Для дыхания каждого вида растений и его органов существуют определенные минимальные (когда дыхание еще возможно), оптимальные и максимальные температуры. В отличие от фотосинтеза дыхание у зимующих растений наблюдается при очень низких температурах (у хвои ели и сосны при — 25 °С). Температурный оптимум его у большинства видов умеренных широт лежит в пределах 35 — 40°С, т.е. на 5 — 10 °С выше, чем для фотосинтеза (рис. 4.14). Максимальные температуры (45 — 55 °С) определяются способностью белков к денатурации.
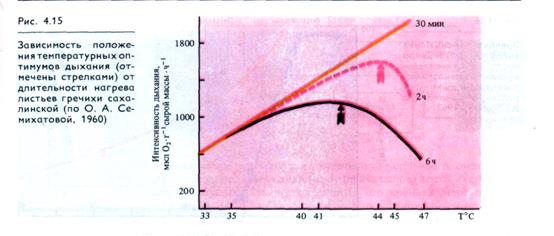
При рассмотрении влияния на дыхание крайних температур важно учитывать продолжительность действия этого неблагоприятного фактора. Так, при кратковременных экспозициях (30 мин) температурный оптимум дыхания листьев гречихи сахалинской может быть очень высок (> 47 °С), тогда как при двухчасовом действии оптимум смещается к 44 °С, а при шестичасовом - до 42 °С (рис. 4.15).
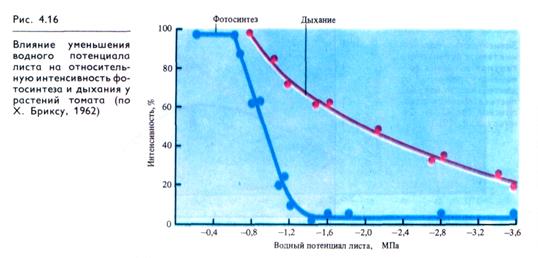
Водный режим. Изменение оводненности тканей растения отражается на интенсивности дыхания. В листьях проростков при быстрой потере воды вначале отмечается усиление дыхания — обычная кратковременная реакция на раздражение. При постепенном снижений оводненности этого не происходит. Продолжающийся водный дефицит вызывает постепенное снижение дыхания, причем более медленное, чем падение интенсивности фотосинтеза (рис. 4.16). Более раннее прекращение фотосинтетической активности при водном дефиците является следствием закрытия устьиц (уменьшение поступления СО2 в лист) и потери тургорного давления в клетках.
Необходимость определенной степени оводненности тканей для процесса дыхания отчетливо проявляется при изучении дыхания семян. Дыхание воздушно-сухих семян (10—11% Н2О) ничтожно мало. При повышении влажности семян до 14—15% дыхание возрастает в 4-5 раз, а при дальнейшем повышении оводненности семян до 30 — 35% дыхание увеличивается в тысячи раз. При этом важную роль играет температура, при которой хранятся семена: при 0— 10 °С влияние влажности на интенсивность дыхания значительно меньше, чем при 18 — 25 °С. Резкий подъем дыхания набухших семян сопровождается значительным выделением тепла, что может привести к их перегреву («самовозгоранию») при хранении.
Реакция растительных тканей на потерю воды зависит также от возраста, физиологического состояния, экологической принадлежности организма.
Минеральные вещества. Добавление раствора солей в воду, на которой выращивают проростки, обычно усиливает дыхание корней. Этот эффект получил название «солевого дыхания». Полагают, что солевое дыхание отражает усиление обмена веществ, необходимое для энергетической поддержки активного транспорта ионов корнем. Однако до конца это явление не изучено. Отмечены случаи, когда увеличенная интенсивность дыхания сохранялась после удаления солей. В тканях других органов этот эффект удается получить не всегда.
Свет. Действие света на дыхание зеленых органов растений из-за методических трудностей изучено недостаточно, так как одновременно с дыханием в них осуществляется фотосинтез. Освещенность, при которой интенсивность фотосинтеза равна интенсивности дыхания (по уровню поглощенного и выделенного СО2), называется компенсационным пунктом.
При работе с незелеными растениями или с незелеными органами растений возможно непосредственное изучение действия света на дыхание. Дыхание (поглощение О2 и выделение СО?) незеленых тканей активируется светом коротковолновой части спектра — ближним ультрафиолетом (380 нм), синими и зелеными лучами (400-500 нм) (табл. 4.3).
В области 380—600 нм лежат максимумы поглощения каро-тиноидов, флавинов (см. рис. 13.5) и всех цитохромов дыхательной цепи митохондрий (см. табл. 4.1). Усиление дыхания может быть связано с прямым действием света на эти компоненты окислительно-восстановительных систем клеток.
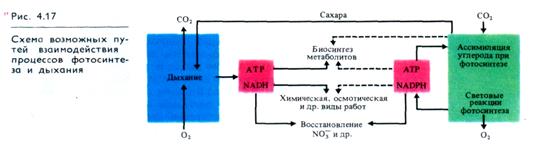
Остается нерешенным вопрос о характере взаимодействия процессов фотосинтеза и дыхания в зеленых клетках в ходе фотосинтеза. Обсуждаются две точки зрения об использовании АТР, образующегося при фотофосфорилировании. Согласно одной из них на свету хлоропласты большую часть синтезируемой при фотофосфорилировании АТР используют на синтез углеводов, отдавая на нужды клетки лишь небольшую ее часть. АТР в цитоплазму поставляют митохондрии, которые используют ассимиляты (рис. 4.17). В темноте хлоропласты сами нуждаются в поступлении энергии из цитоплазмы.
По другой гипотезе АТР фотосинтеза на свету обеспечивает энергией не только фиксацию СО2, но и другие энергозависимые процессы в клетке. Окислительное фосфорилирование в митохондриях на свету резко замедляется, а цикл Кребса ускоряется, так как его интермедиаты необходимы для функционирования хлоропластов.
Повреждения и механические воздействия. Механические воздействия, например на листья, вызывают кратковременное усиление поглощения О2 (от нескольких минут до часа). При этом надавливание влияет мало, изгибание — сильнее и очень сильно — срезание.
Таблица 4.3 Влияние синего и красного света одинаковой интенсивности (3- 10~3 Дж/см2-с) на поглощение О2 (мкл на 10 см2 в ч) этиолированными листьями кукурузы и незелеными участками листьев пестролистных растений (Воскресенская, Зак, 1957)
| Объект | Темнота | Синий свет | Красный свет |
| Этиолированные листья кукурузы (12 —15 дн.) | 15,1 | 42,0 | 17,0 |
| Желтые участки листьев Codiaeum pictum | 33,0 | 43,0 | 35,0 |
| Белые участки листьев Aspidistra elatior | 22,0 | 52,0 | 22,0 |

Поранение (нарушение целостности тканей) может стимулировать поглощение О2 по крайней мере по трем причинам: 1) из-за быстрого окисления фенольных и других веществ, которые выходят из вакуолей поврежденных клеток и становятся доступными для соответствующих оксидаз; 2) в связи с увеличением количества субстратов для дыхания; 3) вследствие активации процессов восстановления мембранного потенциала и поврежденных клеточных структур.
Наиболее высокой интенсивностью дыхания обладают молодые органы и ткани растений, находящиеся в состоянии активного роста (рис. 4.18). Пока молодой лист развертывается и увеличивает свою площадь, интенсивность дыхания нарастает. Повышение интенсивности дыхания прекращается, когда заканчивается рост листа (т. е. когда общее число и размер клеток в тканях листа больше не увеличиваются). Затем дыхание снижается до уровня, приблизительно равного половине максимального, и довольно долго остается без изменений. Цветение и плодоношение сопровождаются усилением дыхания развивающихся цветков и плодов, что связано с образованием новых органов и тканей, обладающих высоким уровнем обмена веществ.
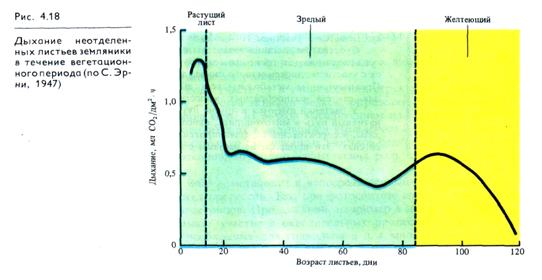
В период, предшествующий полному созреванию сочных плодов (размягчению), наблюдается значительное кратковременное (на 2 — 3 дня) усиление дыхания тканей плода, после чего продолжается неуклонное падение поглощения О2. Подъем интенсивности дыхания перед полным созреванием плодов называется климактерическим подъемом дыхания. Сходное явление наблюдается и при пожелтении листьев (рис. 4.18). Перед климактерическим подъемом дыхания в тканях резко усиливается образование этилена, который оказывает на обмен двоякое влияние. С одной стороны, увеличивается проницаемость мембран и усиливается гидролиз белков, в результате чего возрастает количество доступных дыхательных субстратов. С другой стороны, в период подъема климактерического дыхания стимулируется синтез белков, возможно, дыхательных ферментов. Необходимо отметить, что климактерическое усиление дыхания является аэробным процессом и предотвращается хранением плодов при сниженном парциальном давлении кислорода в присутствии высокого содержания азота, СО2 и при низкой температуре.
Таким образом, активность дыхательных систем изменяется в соответствии с потребностями процессов роста и развития растения.
Дыхание необходимо для освобождения химической энергии окисляемых субстратов. В реакциях гликолиза (анаэробного этапа дыхания) и дыхательных циклов (цикл ди- и трикарбоновых кислот, пенто-зофосфатный цикл) восстанавливаются коферменты, которые затем окисляются кислородом воздуха в электронтранспортной цепи митохондрий (NADH, FADN2) или используются для синтетических процессов (преимущественно NADPH). Энергия дыхания, помимо восстановленных коферментов, запасается в форме АТР в результате субстратного и окислительного фосфорилирования. Последнее осуществляется с участием Н+-помпы.
Субстратом дыхания является главным образом глюкоза, но могут использоваться также аминокислоты и жиры. Жиры утилизируются с участием глиоксилатного цикла, локализованного в глиоксисомах. Промежуточные метаболиты всех дыхательных циклов необходимы для синтеза разнообразных веществ, входящих в состав клетки.
У растений имеются и другие пути окисления субстратов: альтернативный путь в митохондриях, окисление с участием полифенолоксидазы, аскорбатоксидазы, флавопротеиновых оксидаз, пероксидаз и ок-сигеназ. Эти процессы не связаны с запасанием энергии.
 Глава 5
Глава 5
ВОДНЫЙ ОБМЕН
«Вода! У тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать... Нельзя сказать, что ты необходима для жизни, ты сама жизнь... Ты самое большое богатство в мире».
Антуан де Сент-Экзюпери

В тканях растений вода составляет 70 — 95% сырой массы. Обладая уникальными свойствами, вода играет первостепенную роль во всех процессах жизнедеятельности. Однако ее структура в клетках и роль в различных явлениях на молекулярном уровне изучены далеко недостаточно.
Роль воды в целом организме весьма многообразна. Поскольку жизнь зародилась в водной среде, то эта среда оказалась замкнутой в клетках, а у животных — еще и в виде цело-мической жидкости (лимфа, кровь). Все известные на Земле формы жизни не могут существовать без воды. При снижении содержания воды в клетках и тканях до критического уровня (например у спор, у семян при их полном созревании) живые структуры переходят в состояние анабиоза.
 Вода в биологических объектах выполняет следующие основные функции:
Вода в биологических объектах выполняет следующие основные функции:
1. Водная среда объединяет все части организма, начиная от молекул в клетках и кончая тканями и органами, в единое целое. В теле растения водная фаза представляет собой непрерывную среду на всем протяжении от влаги, извлекаемой корнями из почвы, до поверхности раздела жидкость — газ в листьях, где она испаряется.
2. Вода — важнейший растворитель и важнейшая среда для биохимических реакций.
 3. Вода участвует в упорядочении структур в клетках. Она входит в состав молекул белков, определяя их конформацию. Удаление воды из белков высаливанием или с помощью спирта приводит к их коагуляции и выпадению в осадок. В поддержании структур гидрофобных участков белковых молекул и липопротеинов, возможно, существенна роль структурированной воды.
3. Вода участвует в упорядочении структур в клетках. Она входит в состав молекул белков, определяя их конформацию. Удаление воды из белков высаливанием или с помощью спирта приводит к их коагуляции и выпадению в осадок. В поддержании структур гидрофобных участков белковых молекул и липопротеинов, возможно, существенна роль структурированной воды.
4. Вода — метаболит и непосредственный компонент биохимических процессов. Так, при фотосинтезе вода является донором электронов. При дыхании, например в цикле Кребса, вода принимает участие в окислительных процессах (см. рис. 4.3). Вода необходима для гидролиза и для многих синтетических процессов.
5. Возможно, существенную роль в жизненных явлениях,
особенно в мембранных процессах, играет относительно высокая протонная и электронная проводимость структурированной воды.
6. Вода — главный компонент в транспортной системе высших растений — в сосудах ксилемы и в ситовидных трубках флоэмы, при перемещении веществ по симпласту и апопласту.
7. Вода — терморегулирующий фактор. Она защищает ткани от резких колебаний температуры благодаря высокой теплоемкости и большой удельной теплоте парообразования.
8. Вода — хороший амортизатор при механических воздействиях на организм.
9. Благодаря явлениям осмоса и тургора (напряжения) вода обеспечивает упругое состояние клеток и тканей растительных организмов.
В ходе прогрессивной эволюции растительные организмы приобретали все большую относительную независимость от воды. Для водорослей вода — это среда обитания. Наземные споровые растения еще сохраняют зависимость от капельножидкой воды в период размножения с участием гамет, передвигающихся с помощью жгутиков. Семенные растения, у которых появляется пыльца, уже не нуждаются в свободной воде для полового процесса. У них совершенствуются механизмы поступления и экономного расходования воды, необходимой для жизнедеятельности растительных организмов.
Вода может находиться в трех агрегатных состояниях — газообразном, жидком и твердом. В каждом из этих состояний структура воды неодинакова. В зависимости от состава находящихся в ней веществ вода приобретает новые свойства. Твердое состояние воды также бывает по крайней мере двух типов: кристаллическое — лед и некристаллическое — стеклообразное, аморфное (состояние витрификации). При мгновенном замораживании с помощью, например, жидкого азота молекулы не успевают построиться в кристаллическую решетку и вода приобретает твердое стеклообразное,- состояние. Именно это свойство воды позволяет замораживать'без повреждения живые организмы, такие, как одноклеточные водоросли, листочки мха Mnium, состоящие из двух слоев клеток. Замораживание же с образованием кристаллической воды приводит к повреждению клеток.
Для кристаллического состояния воды характерно большое разнообразие форм. Давно замечено, что кристаллические структуры воды напоминают радиолярии, листья папоротника, цветы. По этому поводу А. А. Любищев высказал предположение, что законы кристаллизации в чем-то сходны с законами образования живых структур.
Физические свойства воды. Вода — самое аномальное вещество, хотя принята за эталон меры плотности и объема для других веществ.
Плотность. Все вещества увеличивают объем при нагревании, уменьшая при этом плотность. Однако при давлении 0,1013 МПа (1 атм) у воды в интервале от 0 до 4°С при увеличении температуры объем уменьшается и максимальная плотность наблюдается при 4°С (при этой температуре 1 см3 воды имеет массу 1 г). При замерзании объем воды резко возрастает на 11 %, а при таянии льда при 0°С так же резко уменьшается. С увеличением давления температура замерзания воды понижается через каждые 13,17 МПа (130 атм) на 1°С. Поэтому на больших глубинах при минусовых температурах вода в океане не замерзает. С увеличением температуры до 100°С плотность жидкой воды понижается на 4% (при 4°С плотность ее равна 1).
Точки кипения и замерзания (плавления). При давлении 0,1013 МПа (1 атм) точки замерзания и кипения воды находятся при 0°С и 100°С, что резко отличает Н2О от соединений водорода с элементами VI группы периодической системы Менделеева. В ряду Н2Те, H2Se, H2S и т. д. с увеличением относительной молекулярной массы точки кипения и замерзания этих веществ повышаются. При соблюдении этого правила вода должна была бы иметь точки замерзания между — 90 и — 120°С, а кипения — между 75 и 100°С. Температура кипения воды возрастает с увеличением давления, а температура замерзания (плавления) — падает.
Теплота плавления. Скрытая теплота плавления льда очень высока — около 335 Дж/г (для железа — 25, для серы — 40). Это свойство выражается, например, в том, что лед при нормальном давлении может иметь температуру от — 1 до — 7°С. Скрытая теплота парообразования воды (2,3 кДж/г) почти в 7 раз выше скрытой теплоты плавления.
Теплоемкость. Величина теплоемкости воды (т. е. количество теплоты, необходимое для повышения температуры на 1°С) в 5 —30 раз выше, чем у других веществ. Лишь водород и аммиак обладают большей теплоемкостью. Кроме того, лишь у жидкой воды и ртути удельная теплоемкость с повышением температуры от 0 до 35°С падает (затем начинает возрастать). Удельная теплоемкость воды при 16°С условно принята за единицу, служа эталоном для других веществ. Поскольку теплоемкость песка в 5 раз меньше, чем у жидкой воды, то при одинаковом нагреве солнцем вода в водоеме нагревается в 5 раз слабее, чем песок на берегу, но во столько же раз дольше сохраняет теплоту. Высокая теплоемкость воды защищает растения от резкого повышения температуры при высокой температуре воздуха, а высокая теплота парообразования участвует в терморегуляции у растений.
Высокие температуры плавления и кипения, высокая теплоемкость свидетельствуют о сильном притяжении между соседними молекулами, вследствие чего жидкая вода обладает большим внутренним сцеплением.
Поверхностное натяжение и прилипание. На поверхности воды из-за нескомпенсированности сцепления (ко-гезии) ее молекул создается поверхностное натяжение, величина которого при 18°С равна 0,72 мН/см (выше только у ртути — 5 мН/см). Вода обладает также свойством адгезии (прилипания), которое обнаруживается при ее подъеме против гравитационных сил. В капиллярах сочетаются силы сцепления молекул воды в пограничном с воздухом слое с ее адгезией с материалом стенок капилляра. В результате в капилляре образуется вогнутая поверхность воды выше ее исходного уровня. У ртути, не обладающей свойством адгезии, поверхность мениска в капилляре выпуклая. То же наблюдается в капиллярах с несмачиваемыми водой стенками.
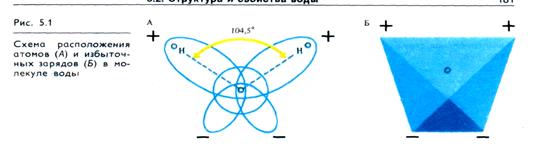
Молекулярное строение воды. В молекуле воды две пары электронов являются общими для ядер водорода и кислорода. Они имеют сильно вытянутые орбиты и, так как более электроотрицательный атом кислорода притягивает электроны от атомов водорода, несут частичные положительные заряды, а атом кислорода с двумя неподеленными парами электронов имеет частичный отрицательный заряд (рис. 5.1, А).
Поскольку в молекуле воды разноименные заряды пространственно разделены, она при общей электронейтральности является диполем. Вследствие того что орбиты с неподеленными электронами атома кислорода лежат в плоскости, перпендикулярной плоскости молекулы, а угол между ядрами водорода составляет 104,5° (109,5° для льда), возникает структура тетраэдра с четырьмя полюсами электрических зарядов: двумя положительными и двумя отрицательными (рис. 5.1, Б).
Каждая молекула воды, являясь диполем с тетраэдрическим распределением электронов вокруг атома кислорода, может взаимодействовать с четырьмя другими молекулами воды за счет электростатического взаимодействия атомов Н и О соседних молекул:
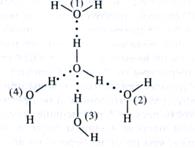
Молекулы 1 и 2 находятся в плоскости чертежа; 3 — над плоскостью; 4 — под ней. Такое электростатическое взаимодействие с незначительной долей ковалентности называется водородной связью. Это сравнительно слабая связь, так как в жидкой воде энергия, необходимая для ее разрыва, равна 18,84 кДж/моль (энергия ковалентной связи Н — О в молекуле воды составляет 460,4 кДж/моль). Водородные связи непрерывно возникают и разрушаются. Время полужизни каждой из них — менее 1 • 10-9с.
Ионизация. Поскольку в молекуле воды электроны прочнее связаны с атомом кислорода, происходит отщепление протонов. В результате наблюдается диссоциация молекул воды на ионы водорода (Н+) и гидроксила (ОН-). Но свободный ион Н+ не способен к самостоятельному существованию и немедленно гидратируется молекулой воды с образованием иона гидроксония: Н+ + Н2О↔ H3O+.
Суммарная реакция представляет собой переход протона от одной молекулы воды к другой и образование ионов гидроксония и гидроксила: Н2О + H2O↔ H3O+ + ОН-. Для простоты изложения гидроксоний (Н3О+) обычно обозначают как Н+.
При 25 °С концентрация водородных или гидроксильных ионов в чистой воде составляет 1 • 10-7 моль/л, что соответствует рН 7.
Вода как растворитель. Полярность молекулы воды обусловливает ее свойство растворять вещества лучше, чем другие жидкости. Растворение кристаллов неорганических солей осуществляется благодаря гидратации входящих в их состав ионов. Хорошо растворяются в воде органические вещества, с карбоксильными, гидроксильными, карбонильными и с другими группами которых вода образует водородные связи.
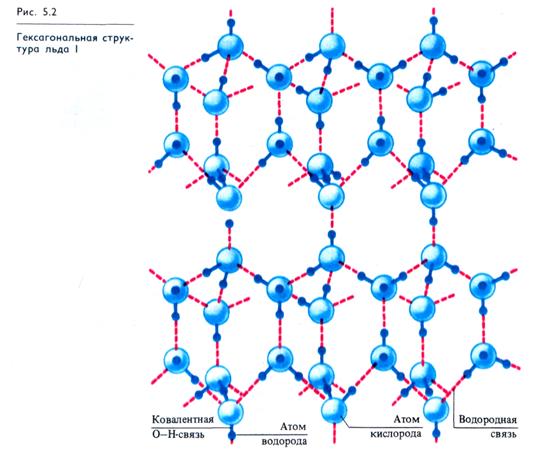
Структура льда и жидкой воды. Несмотря на интенсивные исследования, особенности структуры воды в различных ее состояниях окончательно не выяснены. В структуре льда, полученного при нормальных условиях давления (лед I), каждая молекула воды окружена четырьмя другими, образующими тетраэдр, в центре которого располагается молекула воды, связанная четырьмя водородными связями с молекулами воды, расположенными в вершинах тетраэдра. В целом образуется гексагональная кристаллическая структура льда (рис. 5.2). Среднее расстояние между атомами кислорода для льда составляет 0,276 нм. При плавлении льда увеличивается расстояние между атомами кислорода (при 15°С оно равно 0,29 нм). Одновременно разрушается около 15% водородных связей. Вместо 12 ближайших молекул у каждой молекулы воды оказываются от 3,4 до 4,5 соседних молекул.
Существуют две группы гипотез, объясняющих структуру жидкой воды. К гипотезам первой группы относится представление О. Я. Самойлова (1946, 1957) о том, что жидкая вода обладает однородной (ажурной) льдоподобной структурой, в пустотах которой находятся мономерные молекулы воды, не имеющие или имеющие малое число водородных связей. Структура льдоподобного каркаса воды может нарушаться тепловым движением молекул и ионами, превышающими размеры пустот (К +, Rb +, Cs+), тогда как А13 +, Li +, ОН-, SO2-4 укрепляют однородную структуру воды. Тепловое движение молекул воды осуществляется по полостям каркаса, не связанным друг с другом водородными связями.
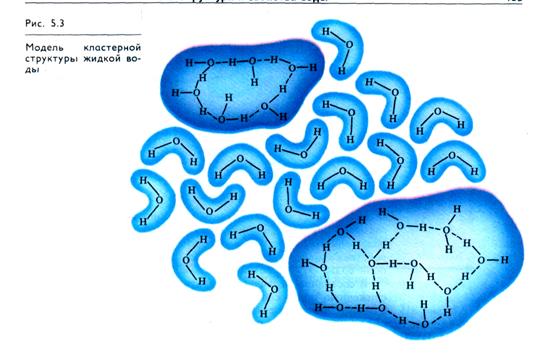
Согласно гипотезам второй группы вода представляет собой равновесную смесь льдоподобных образований и мономерных молекул (рис. 5.3). В жидкой воде появление участков (кластеров, роев), объединенных взаимодействующими водородными связями, чередуется с областями, где водородные связи отсутствуют или реализованы лишь частично. Чередующиеся зоны, или «мерцающие кластеры», возникают и исчезают вследствие локальных энергетических флуктуации. Время жизни кластеров 10-10 -10-11 с. В каждый данный момент времени в образовании «мерцающих кластеров» участвует до 2/з молекул воды.
Возможно, что между этими группами гипотез нет принципиальных различий. Их объединяют следующие представления: существование водородных связей, участвующих в создании организованных структур; существование двух типов структур: с упорядоченной ориентацией молекул (льдоподоб-ная структура, кластеры) и неупорядоченной структуры
с малым числом водородных связей; разрушающее влияние теплового движения молекул на структуру воды; кооперативные свойства воды.
 Растворы электролитов. В растворах, содержащих ионы, структура воды существенно меняется. В разбавленных растворах (<0,1 моль/л) это происходит благодаря заряженным ионам. Эффект зависит от поляризующей силы иона, которая. определяется плотностью заряда (отношение заряда иона к его радиусу). Маленькие ионы с большой плотностью заряда сильнее действуют на структуру чистой воды по сравнению с большими ионами, имеющими малую плотность заряда. И те и другие разрушают структуру воды: первые притягивают молекулы воды, вторые при внедрении в воду из-за большого размера разрушают льдоподобный каркас. При этом может меняться вязкость водного раствора: структура, создаваемая, слабогидратированными большими ионами (с малым зарядом), делает вязкость раствора ниже вязкости чистой воды (Li+, Na+, Mg2+, F-), а более плотная структура, образуемая гидратированными ионами, обусловливает более высокую вязкость, чем в чистой воде (К+, Rb +, NH+4, Cs +, Сl-, ОН-, NO-3 и др.).
Растворы электролитов. В растворах, содержащих ионы, структура воды существенно меняется. В разбавленных растворах (<0,1 моль/л) это происходит благодаря заряженным ионам. Эффект зависит от поляризующей силы иона, которая. определяется плотностью заряда (отношение заряда иона к его радиусу). Маленькие ионы с большой плотностью заряда сильнее действуют на структуру чистой воды по сравнению с большими ионами, имеющими малую плотность заряда. И те и другие разрушают структуру воды: первые притягивают молекулы воды, вторые при внедрении в воду из-за большого размера разрушают льдоподобный каркас. При этом может меняться вязкость водного раствора: структура, создаваемая, слабогидратированными большими ионами (с малым зарядом), делает вязкость раствора ниже вязкости чистой воды (Li+, Na+, Mg2+, F-), а более плотная структура, образуемая гидратированными ионами, обусловливает более высокую вязкость, чем в чистой воде (К+, Rb +, NH+4, Cs +, Сl-, ОН-, NO-3 и др.).
В электрическом поле катиона все ближайшие молекулы воды ориентируются отрицательными полюсами внутрь (рис. 5.4), а вокруг аниона внутрь направлены положительные полюсы молекул воды. Этот внутренний, прочно связанный с ионом слой молекул воды называют первичной, или ближней, гидратацией (сольватацией) (рис. 5.5). В процессе электрофореза он движется вместе с ионом как одно целое. Однако ион, связывая определенное число молекул воды из своего непосредственного окружения, в результате иондипольного взаимодействия ориентирует также более далеко расположенные диполи воды. Эту гидратацию называют вторичной или дальней.
 2015-05-26
2015-05-26 1727
1727








