| Реакция | Ео |

| +1.229 |


| +0.174 +0.144 |


| -0.082 -0.155 |


| -0.441 -0.464 |
 
| -1.400 |
Для серы свойственно образование полисульфанов H2Sn. Соединения с n = 2-8 выделены в индивидуальном состоянии, более высокие гомологи - пока только в виде смесей. У селена и теллура в результате окисления селенидов и теллуридов в растворах осаждающиеся простые вещества взаимодействуют с халькогенидами, образуя полиселениды и полителлуриды (Na2Sе4, Na2Te6). Однако отвечающие им водородные соединения не выделены.
Полисульфаны синтезируют различными путями:
Na2S n (р) + 2HCl (p) = 2NaCl (p) +H2S n (р) (n = 4-6)
S nCl2 (ж) +2H2S (ж) =2НCl (г) + H2S n+2(ж)
Молекулы полисульфанов образованы неразветвленными цепочками из атомов серы. Они неустойчивы, легко диспропорционируют на H2S и свободную серу. Бесцветный дисульфан H2S2 является аналогом пероксида водорода H2O2, он имеет аналогичное строение и проявляет окислительные свойства. С помощью H2S2 окисляют сульфиды GeS иSnSдо тиопроизводных Gе(IV) и Sn(IV), а сульфиды As2S3и Sb2S3- до тиопроизводных As(V) и Sb(V):
GeS + (NH4)2S2  (NH4)2GeS3
(NH4)2GeS3
|
|
|
As2S3 + 2(NH4)2S2 = 2 NH4 AsS3 + (NH4)2S.
§ 8. Получение гидридов Н2Э
Среди гидридов халькогенов единственным термодинамически стабильным оказывается сероводород Н2S (табл.5). Необходимо отметить его сильную токсичность и опасность для человека, сравнимую с синильной кислотой HCN.
Н2S и до некоторой степени Н2Se могут быть получены непосредственно из простых веществ, тогда как Н2Te и Н2Ро синтезировать таким образом невозможно из-за их термической нестойкости. Н2Те выше 0оС распадается во влажном воздухе и на свету. Н2Ро еще менее устойчив и может быть получен лишь в следовых количествах.
Гидриды халькогенов легко синтезируют, обрабатывая халькогениды металлов водой или кислотами:
FeS +2HCl  H2S
H2S  + FeCl2
+ FeCl2
Al2Se3 + 6H2O  H2Se
H2Se 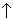 + 2Al(OH)3 Ї
+ 2Al(OH)3 Ї
Al2Te3 + 6HCl 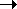 2 H2Te
2 H2Te 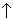 + 2AlCl3.
+ 2AlCl3.
H2Teудобно также получать катодным восстановлением теллура при 0оС. Анодом служит платиновый электрод, а электролитом 50%-ная серная кислота
 (катод)
(катод)

§ 9. Сульфиды металлов.
Процессы получения многих металлов сводятся к переработке их сульфидов.
При обработке сульфидов на воздухе возможны 3 пути:
1.превращение в оксид;
2.образование водорастворимых сульфатов для использования в процессах гидрометаллургии;
3.окисление до металлов (HgS + O2 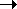 Hg + SO2).
Hg + SO2).
Эти возможности могут быть оценены с помощью фазовой диаграммы трехкомпонентной системы M- S- O2, построенной в логарифмических координатах давлений SO2 и О2.

Рис.5. Изотермическая диаграмма  для системы M(II)-S-O2.
для системы M(II)-S-O2.
Согласно правилу Гиббса с = k + 2 -  (с - число степеней свободы,
(с - число степеней свободы,  - число фаз, k - число компонентов), в системе металл- сера- кислород при заданных температуре и давлении газовой фазы в равновесии сосуществуют максимально 3 фазы. На рис.5 изображена фазовая диаграмма для системы М(II)- S- O2.
- число фаз, k - число компонентов), в системе металл- сера- кислород при заданных температуре и давлении газовой фазы в равновесии сосуществуют максимально 3 фазы. На рис.5 изображена фазовая диаграмма для системы М(II)- S- O2.
|
|
|
Границы между фазовыми полями - прямые линии. Границы между фазами М/МО и MS/MSO4 вертикальные, границы между другими фазами наклонные: у М/МS наклон равен 1.0, у МS/МО наклон равен 1.5 и у МО/ MSO4 наклон составляет - 0.5. В условиях постоянных температур на границе М/МО происходит процесс МО = М + 1/2О2(г), константа равновесия которого равна  . Отсюда следует р(О2) = =2logKр = константа и, таким образом, величина р(О2) не зависит от р(SO2). На границе MS/MSO4 протекает процесс MSO4 = МS + 2О2(г), константа равновесия которого равна
. Отсюда следует р(О2) = =2logKр = константа и, таким образом, величина р(О2) не зависит от р(SO2). На границе MS/MSO4 протекает процесс MSO4 = МS + 2О2(г), константа равновесия которого равна  . Отсюда вытекает, что log p(О2) = 1/2 log Kp = константа и величина р(О2) также не зависит от р(SO2). На границе М/МS в равновесии MSтв+О2(г) = Мтв + SO2(г) участвуют 2 газа. Константа равновесия Кр = р(SO2) / p(О2). Из этого следует, что log p(SO2) = log Kр + log р(О2), и наклон граничной линии М/МS равен 1.0.
. Отсюда вытекает, что log p(О2) = 1/2 log Kp = константа и величина р(О2) также не зависит от р(SO2). На границе М/МS в равновесии MSтв+О2(г) = Мтв + SO2(г) участвуют 2 газа. Константа равновесия Кр = р(SO2) / p(О2). Из этого следует, что log p(SO2) = log Kр + log р(О2), и наклон граничной линии М/МS равен 1.0.
На границе МS/МО в равновесии также участвуют 2 газа, но в других мольных соотношениях: MS + 3/2O2(г) = МО + SO2(г) .  . Следовательно,
. Следовательно,  , и наклон равен 1.5. На границе МО/ MSO4 2 газа появляются в качестве продуктов распада: MSO4 = MO + SO2(г) + +1/2O2(г). Константа равновесия
, и наклон равен 1.5. На границе МО/ MSO4 2 газа появляются в качестве продуктов распада: MSO4 = MO + SO2(г) + +1/2O2(г). Константа равновесия  . Отсюда
. Отсюда  , то есть наклон равен - 0.5.
, то есть наклон равен - 0.5.
Используя диаграмму р(SO2) - p(О2) (рис.5), можно оценить состав продуктов окисления сульфидов M(II) в различных условиях. Например, при давлении p(О2) ~ 10-8 атм и р(SO2) ~ 2. 10-2 атм (точка а на рис.5) сульфид металла MS окисляется до оксида МО, а при p(О2) ~ 10-4 атм и р(SO2) ~ 1.7 атм (точка b на рис.5) - до сульфата MSO4.
§ 10. Оксиды халькогенов.
Наиболее важными являются ди- (ЭО2) и триоксиды (ЭО3) халькогенов. Для серы же известен и ряд других нестабильных оксидов. Оксид S2Oполучают пропусканием тионилхлорида над сульфидом серебра
SOCl2 + Ag2S 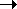 S2O + 2AgCl.
S2O + 2AgCl.
Оксид S8O получают из H2S7 и SOCl2:
 или окислением S8 трифторуксусной кислотой.
или окислением S8 трифторуксусной кислотой.
 2020-06-29
2020-06-29 126
126








