3)  ;
;
4)  .
.
(−814,2 кДж/моль)
3. Энтальпии растворения в воде кристаллогидратов  и
и  с образованием раствора состава
с образованием раствора состава  равны соответственно 10,8 и 45,0 кДж/моль. Рассчитать энтальпию реакции:
равны соответственно 10,8 и 45,0 кДж/моль. Рассчитать энтальпию реакции:
 .
.
(−34,2 кДж)
4. Вычислить стандартное значение энтальпии связи азот–кислород в молекуле 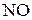 по следующим данным:
по следующим данным:
1) 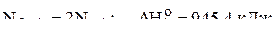 ;
;
2)  ;
;
 .
.
(631,7 кДж/моль связи)
5. Зная величины
 ;
;
 ;
;
 ,
,
определить стандартную энтальпию образования иона  в водном растворе. (−167,1 кДж/моль)
в водном растворе. (−167,1 кДж/моль)
6. Вычислить энтальпию разбавления водного раствора нитрата свинца моляльности 0,556 до моляльности 0,111 по следующим данным:


(3,4 кДж/моль)
Вариант 4
1. Вычислить стандартную энтальпию реакции

по справочным данным. Рассчитать стандартное значение внутренней энергии для этого процесса. (− 91,5 кДж; − 86,5 кДж)
2. Определить стандартную энтальпию образования газообразной воды, используя следующие термохимические данные:
1)  ;
;
2)  ;
;
3)  .
.
(− 241,8 кДж/моль)
3. Энтальпии растворения  в воде с образованием раствора состава
в воде с образованием раствора состава  равна 20,7 кДж/моль, а энтальпия реакции
равна 20,7 кДж/моль, а энтальпия реакции

составляет −87,6 кДж. Рассчитать энтальпию реакции растворения в воде безводного сульфата железа(II) с образованием раствора состава  . (− 66,9 кДж/моль)
. (− 66,9 кДж/моль)
4. Вычислить стандартное значение средней энтальпии связи фосфор–водород в молекуле фосфина по следующим данным:
1)  ;
;
2)  ;
;
 .
.
(321,7 кДж/моль связи)
5. Зная величины
 ;
;
 ;
;
 ;
;
 ,
,
определить стандартную энтальпию образования  .(−393,5 кДж/моль)
.(−393,5 кДж/моль)
6. Стандартная энтальпия образования  равна −795,9 кДж/моль, а энтальпия растворения этого соединения в воде с образованием растворов моляльной концентрации 2,78 и 1,11 равны соответственно −74,4 и −77,3 кДж/моль. Вычислить энтальпию образования раствора состава
равна −795,9 кДж/моль, а энтальпия растворения этого соединения в воде с образованием растворов моляльной концентрации 2,78 и 1,11 равны соответственно −74,4 и −77,3 кДж/моль. Вычислить энтальпию образования раствора состава  . (−872,2 кДж/моль)
. (−872,2 кДж/моль)
Вариант 5
1. Вычислить стандартную энтальпию реакции

по следующим данным:
 ;
;
 ;
;
 .
.
(−269,5 кДж)
2. Какое количество теплоты выделится при сгорании 24 г метана, если известны следующие термохимические данные:
1)  ;
;
2)  ;
;
3)  .
.
(1335,5 кДж)
3. Энтальпии растворения  и
и  в воде с образованием раствора состава
в воде с образованием раствора состава  равны соответственно −80,1 и 7,9 кДж/моль. На основе этих данных рассчитать энтальпию реакции:
равны соответственно −80,1 и 7,9 кДж/моль. На основе этих данных рассчитать энтальпию реакции:
 .
.
(−88,0 кДж)
4. Вычислить стандартное значение энтальпии связи водород–бром в молекуле бромоводорода по следующим данным:
1)  ;
;
2)  ;
;
3)  ;
;
 .
.
(366,1 кДж/моль связи)
5. Зная величины
 ;
;
 ;
;
 ,
,
определить стандартную энтальпию образования в растворе бромида натрия. (− 361,8 кДж/моль)
6. Вычислить энтальпию растворения газообразного HBr в воде с образованием двумоляльного раствора по следующим данным:



(−83,0 кДж/моль)
11. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Пример 1. Привести уравнения для вычисления констант равновесия 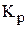 и
и 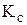 следующих процессов:
следующих процессов:
а) 

 ;
;
б) 

 ;
;
в) 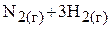

 ;
;
г) 

 .
.
Для гомогенной реакции, протекающей в газовой фазе, установить отношение между 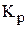 и
и 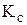 .
.
Решение. Для гетерогенных процессов концентрации веществ, находящихся в конденсированной (жидкой или твёрдой) фазе, не входят в выражение для константы равновесия. В связи с этим выражения для констант равновесия процессов а)–г) имеют вид:
а)  ;
;  ;
;
б)  ;
;  ;
;
в)  ;
;  ;
;
г)  .
.
Из уравнения Менделеева–Клапейрона  следует, что
следует, что
 ,
,
где С – концентрация реагента в моль/л.
Тогда для процесса в) имеем:

где показатель степени (−2) представляет собой разность между суммарным количеством газообразных веществ продуктов реакции и исходных веществ:
 .
.
Пример 2. В замкнутый сосуд ввели газообразные вещества А, В и С, их исходные концентрации составили по 3 моль/л. После установления в системе химического равновесия



при некоторой температуре равновесная концентрация вещества С составила 5 моль/л. Вычислите равновесный выход продукта реакции С в тех же условиях, если исходные концентрации веществ А и В составляли по 8 моль/л.
Решение. Концентрация вещества С, полученного в результате взаимодействия веществ А и В, возросла на (5−3)=2 моль/л. Следовательно, в соответствии со стехиометрическим уравнением реакции исходные концентрации веществ А и В уменьшились на 1 моль/л.
Тогда равновесные концентрации реагентов составят, моль/л:



2 2 5
Вычисляем константу равновесия процесса
 .
.
Обозначим равновесную концентрацию вещества С, полученную при взаимодействии 8 моль/л А и 8 моль/л В, через х моль/л (в исходном состоянии в системе согласно условию задачи вещества С не было). Следовательно, исходные концентрации реагентов А и В уменьшились на 0,5х моль. Новые равновесные концентрации веществ составят



 (8−0,5х) (8−0,5х) х
(8−0,5х) (8−0,5х) х
Константа равновесия реакции не зависит от концентраций исходных веществ при данных T и P, т.е.
 ,
,
откуда х = 8,89.
Если бы вещества А и В прореагировали полностью, то при 100 %-м выходе концентрация продукта С составила бы 16 моль/л. Следовательно, равновесный выход продукта реакции равен
 .
.
Пример 3. Вычислить константу равновесия 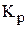 при 298 К для процесса
при 298 К для процесса


 ,
,
используя следующие данные:


 .
.
Давление насыщенного пара метанола при 298 K равно 16200  .
.
Решение. Применяя законы идеального газового состояния для  при давлении 1 атм (101,325 кПа), можно вычислить величину
при давлении 1 атм (101,325 кПа), можно вычислить величину  для процесса
для процесса 

 :
:
 ,
,
где  (для гетерогенной реакции константа равновесия равна давлению паров метанола). Следовательно,
(для гетерогенной реакции константа равновесия равна давлению паров метанола). Следовательно,

(под знаком логарифма должна быть безразмерная величина).
Таким образом, имеем:


 .
.


 .
.
Суммируя эти два уравнения, получаем:


 .
.
Константа равновесия данного процесса определяется из уравнения:
 ,
,
т.е.
 ,
,
откуда
 .
.
Пример 4. В сосуде объёмом 4 л при некоторой температуре установилось равновесие


 .
.
Начальные количества веществ СО и  составляли соответственно 4 и 8 моль. Вычислить равновесные концентрации реагентов и константу равновесия процесса
составляли соответственно 4 и 8 моль. Вычислить равновесные концентрации реагентов и константу равновесия процесса 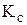 , если к моменту установления равновесия процесса образовалось 2 моль
, если к моменту установления равновесия процесса образовалось 2 моль 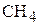 .
.
Решение.



 4 8 0 0
4 8 0 0
 2 2 2 2
2 2 2 2
Равновесные количества реагентов рассчитываются по уравнению реакции, учитывая стехиометрические соотношения между ними. В связи с тем, что продукты реакции (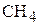 и
и  ) получаются в молярном соотношении 1:1, то равновесные их количества вещества одинаковы и составляют по 2 моль. Следовательно, для получения 2 моль метана (или паров воды), расходуется в 3 раза бóльшее количество вещества водорода, т.е. 6 моль. Тогда равновесное количество вещества
) получаются в молярном соотношении 1:1, то равновесные их количества вещества одинаковы и составляют по 2 моль. Следовательно, для получения 2 моль метана (или паров воды), расходуется в 3 раза бóльшее количество вещества водорода, т.е. 6 моль. Тогда равновесное количество вещества  составляет (8−6) = 2 моль. Количество вещества СО, которое вступило в реакцию, составляет 2 моль, так как количество прореагировавшего вещества СО равно количеству образовавшихся веществ
составляет (8−6) = 2 моль. Количество вещества СО, которое вступило в реакцию, составляет 2 моль, так как количество прореагировавшего вещества СО равно количеству образовавшихся веществ 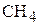 и
и  . Следовательно, равновесное количество вещества СО равно (4−2) = 2 моль.
. Следовательно, равновесное количество вещества СО равно (4−2) = 2 моль.
Вычисляем равновесные концентрации реагентов:
 .
.
Константа равновесия реакции равна:
 .
.
Пример 5. Вычислить температуру, при которой давление газообразных веществ вследствие термической диссоциации хлорида аммония будет равно атмосферному (101,325 кПа), используя следующие данные:

| 
| |

| −314,2 | −203,2 |

| −92,3 | −95,3 |

| −46,2 | −16,71 |
При вычислении принять, что величины  и
и  термического разложения хлорида аммония не зависят от температуры.
термического разложения хлорида аммония не зависят от температуры.
Решение. Для рассматриваемого гетерогенного химического равновесия



пусть Т является температурой, при которой хлорид аммония подвергается термическому разложению. Предполагая, что аммиак и хлороводород при этой температуре подчиняются законам идеального газового состояния, можно считать, что парциальные давление этих газов в смеси одинаковы и составляют по 0,5 атм (суммарное давление образовавшейся газовой смеси равно 1 атм (101,325 кПа), т.е. атмосферному давлению).
Таким образом, 
(или  ).
).
Константа равновесия реакции при температуре Т равна
 ,
,
а  (под знаком логарифма должна стоять безразмерная величина).
(под знаком логарифма должна стоять безразмерная величина).
Если давления компонентов выражены в кПа, величина  не изменится:
не изменится:
 .
.
Используя справочные данные о стандартных энергиях Гиббса образования веществ, вычисляем величину  для рассматриваемой химической реакции
для рассматриваемой химической реакции

 .
.
Используя соотношение  , можно вычислить логарифм константы химического равновесия при 298 К:
, можно вычислить логарифм константы химического равновесия при 298 К:
 ,
,
откуда
 .
.
Находим величину  реакции термического разложения хлорида аммония:
реакции термического разложения хлорида аммония:

 .
.
Решая систему двух уравнений

считая при этом, что величины  и
и  не зависят от Т, т.е.
не зависят от Т, т.е.
 ;
;
 ,
,
получаем, что
 ,
,
т.е.
 ,
,
откуда T = 595 K.
Пример 6. При некоторой температуре и давлении 101,325 кПа степень термической диссоциации иодоводорода по уравнению
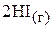


составляет 30 %. Вычислить константы равновесия данного процесса 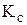 и
и 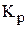 , если начальное количество вещества иодоводорода составляло 1 моль.
, если начальное количество вещества иодоводорода составляло 1 моль.
Решение. Пусть α – количество вещества иодоводорода, подвергшегося термическому разложению. Вычислим равновесные количества и равновесные концентрации веществ:
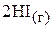


 1 0 0
1 0 0








где V – объём сосуда, в котором проходит реакция.
Данная реакция идёт без изменения объёма, поэтому величины 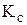 и
и 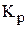 равны друг другу:
равны друг другу:
 .
.
Подставляя в последнее выражение величину α = 0,3, имеем:
 .
.
Вариант 1
1. Привести уравнения для вычисления констант равновесия 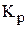 и
и 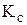 следующих процессов:
следующих процессов:
а) 

 ;
;
б) 

 ;
;
в) 

 ;
;
г) 

 .
.
Для реакций, протекающих в газовой фазе, установить соответствие между 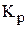 и
и 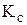 .
.
2. Исходные концентрации метана и оксида углерода(IV) в системе



составляли соответственно 0,4 моль/л и 0,6 моль/л. Вычислить константу равновесия данного процесса, если к моменту наступления равновесия прореагировало 25 мол.% метана. ( )
)
 2020-09-24
2020-09-24 426
426








