г) Вычислим вначале растворимость гидроксида меди(II), Р, моль/л, а также концентрацию ионов 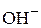 в его насыщенном растворе:
в его насыщенном растворе:
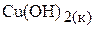


Р, моль/л Р, моль/л 2Р, моль/л
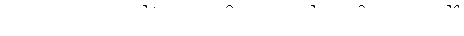 .
.
Следовательно, растворимость 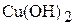 :
:
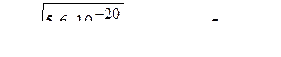 .
.
Тогда, концентрация ионов 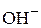 равна:
равна:
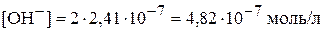 .
.
Величина рН насыщенного раствора 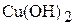 составит:
составит:
 .
.
д) Вычислим растворимость оксалата серебра Р, моль/л:
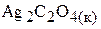


Р, моль/л 2Р, моль/л Р, моль/л
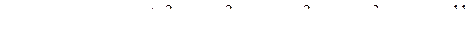 .
.
Величина Р составит:
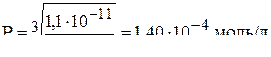 .
.
 , следовательно, количество вещества соли, содержащейся в 2,00 г оксалата серебра, составляет
, следовательно, количество вещества соли, содержащейся в 2,00 г оксалата серебра, составляет
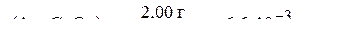 .
.
Объём воды, который необходим для растворения 2,00 г оксалата серебра, равен:
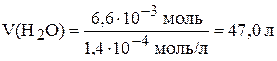 .
.
е) При смешении растворов протекает следующий процесс:


 .
.
Осадок карбоната кальция будет выпадать, если выполняется следующее условие: 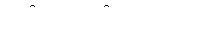 .
.
Концентрация карбонат-ионов известна из условия задачи, она равна молярной концентрации 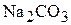 . Ионы кальция, которые при взаимодействии с ионами
. Ионы кальция, которые при взаимодействии с ионами 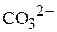 могут образовывать осадок
могут образовывать осадок 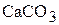 , дают насыщенный раствор сульфита кальция. Концентрацию свободных ионов
, дают насыщенный раствор сульфита кальция. Концентрацию свободных ионов 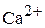 можно вычислить из величины
можно вычислить из величины 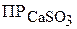 :
:
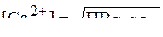 .
.
Вычисляем концентрации ионов 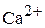 и
и 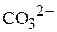 в конечном растворе с учётом разбавления
в конечном растворе с учётом разбавления
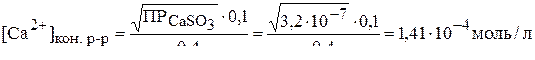 ,
,
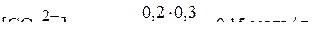 ,
,
и находим произведение концентраций ионов 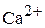 и
и 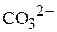
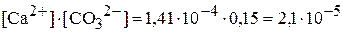 ,
,
которое больше, чем величина 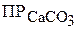 . Это означает, что осадок образуется.
. Это означает, что осадок образуется.
Пример 2. В насыщенный раствор оксалата кальция добавили оксалат натрия до концентрации 0,1 моль/л. Вычислить массу оксалата кальция, которая содержится в 3 л такого насыщенного раствора, если 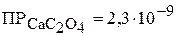 .
.
Решение. В насыщенном растворе оксалата кальция существует равновесие
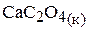

 .
.
При добавлении в насыщенный раствор оксалата кальция сильного электролита, содержащего одноимённый ион  , концентрация оксалат-иона возрастает по сравнению с равновесной концентрацией, характерной для насыщенного раствора.
, концентрация оксалат-иона возрастает по сравнению с равновесной концентрацией, характерной для насыщенного раствора.
В силу этого равновесие в системе сместится влево, оно будет направлено в сторону образования кристаллической фазы оксалата кальция, в результате чего установятся новые равновесные концентрации.
Обозначим растворимость 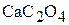 в присутствии
в присутствии 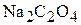 через Р, моль/л. Тогда новые равновесные концентрации составят:
через Р, моль/л. Тогда новые равновесные концентрации составят:
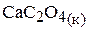

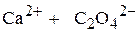
Р, моль/л Р, моль/л (Р+0,1), моль/л
Величина ПР не зависит от концентраций, поэтому
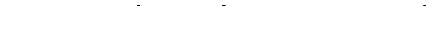 .
.
Величина 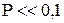 , поэтому для расчёта равновесной концентрации, характерной для нового состояния системы, слагаемым Р в скобках можно пренебречь:
, поэтому для расчёта равновесной концентрации, характерной для нового состояния системы, слагаемым Р в скобках можно пренебречь:
 .
.
Следовательно,
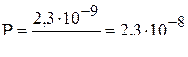 моль/л
моль/л
(Р – молярная концентрация насыщенного раствора).
Вычисляем массу оксалата кальция, которая содержится в 3 л насыщенного раствора
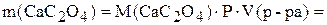
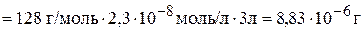 .
.
Пример 3. При 298 К растворимость 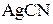 равна
равна 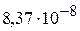 моль/л, а растворимость
моль/л, а растворимость 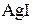 равна
равна 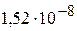 моль/л. Вычислить концентрации ионов
моль/л. Вычислить концентрации ионов 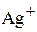 ,
, 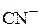 и
и 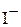 в растворе, насыщенном обеими солями.
в растворе, насыщенном обеими солями.
Решение. Вначале вычислим величины произведений растворимости для обеих солей:
 ,
,
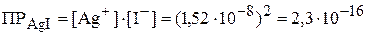 .
.
В растворе, насыщенном обеими солями, концентрация ионов 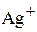 равна сумме концентраций ионов
равна сумме концентраций ионов 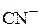 и
и 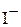 (условие электронейтральнос-ти раствора), т.е.
(условие электронейтральнос-ти раствора), т.е.
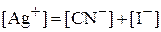 , откуда
, откуда
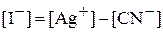 .
.
Составив систему уравнений для величин 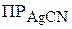 и
и 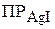 и, сложив их,
и, сложив их,
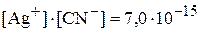
+
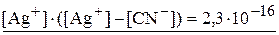
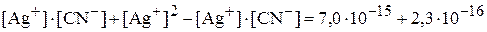 ,
,
решаем полученное уравнение относительно 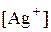 :
:
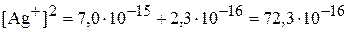 ,
,
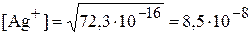 моль/л.
моль/л.
Тогда концентрации ионов 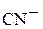 и
и 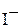 могут быть вычислены из величин
могут быть вычислены из величин 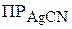 и
и 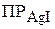 :
:
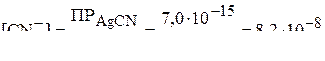 моль/л,
моль/л,
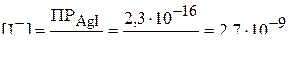 моль/л.
моль/л.
Пример 4. Какие объёмы растворов дигидрофосфата натрия (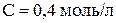 ) и гидрофосфата натрия (
) и гидрофосфата натрия (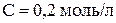 ) необходимо взять для получения 1 л буферного раствора, рН которого равен 7? Считать, что при смешении растворов объём не изменяется. Величина константы диссоциации иона
) необходимо взять для получения 1 л буферного раствора, рН которого равен 7? Считать, что при смешении растворов объём не изменяется. Величина константы диссоциации иона 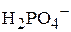 по первой ступени равна
по первой ступени равна  , а величина
, а величина 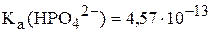 .
.
Решение. Будем считать, что диссоциация иона 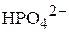 в присутствии дигидрофосфат-иона подавлена, так как
в присутствии дигидрофосфат-иона подавлена, так как
 .
.
В связи с этим величина рН раствора будет определяться следующим уравнением:


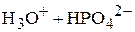
или
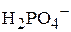

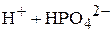 ,
,
константа равновесия которого равна
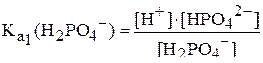 .
.
Откуда
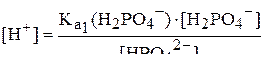 ,
,
а величина
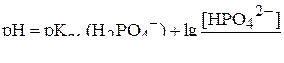 .
.
Пусть объём раствора гидрофосфата натрия равен х л, тогда
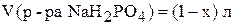 .
.
Количества вещества солей в данных объёмах растворов составят соответственно:
 и
и 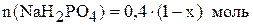 .
.
Эти вещества содержатся в одном и том же объёме буферного раствора, в связи с чем отношение концентраций ионов 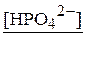 будет равно отношению их количеств
будет равно отношению их количеств 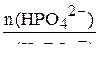 :
:
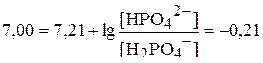 .
.
В последнем уравнении величина
 .
.
Таким образом, отношение концентраций солей 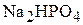 и
и 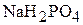 , а, следовательно, и ионов
, а, следовательно, и ионов 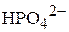 и
и 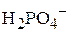 , составит:
, составит:
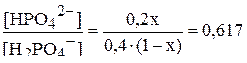 ,
,
откуда 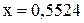 , т.е.
, т.е.
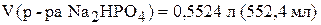 ;
;
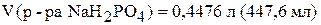 .
.
Пример 5. Вычислить массу хлорида аммония, которую необходимо добавить к 3 л водного раствора аммиака (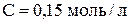 ), чтобы рН полученного буферного раствора стал равным 10,55. Величина
), чтобы рН полученного буферного раствора стал равным 10,55. Величина 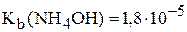 .
.
Решение. Значение рН 10,55 соответствует концентрация ионов водорода 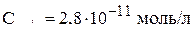 . Тогда концентрация ионов
. Тогда концентрация ионов 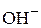 составит
составит
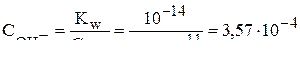 .
.
Для буферного раствора, образованного слабым основанием и его солью справедливо уравнение:
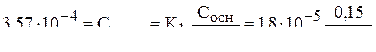 .
.
Из него можно вычислить концентрацию соли в растворе:
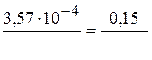 ,
,
откуда
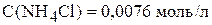 .
.
Тогда масса хлорида аммония, которую следует добавить к 3 л раствора аммиака, составит
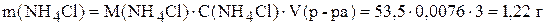 .
.
Пример 6. Вычислить рН буферного раствора, приготовленного смешением 150 мл 0,1 н раствора  и 15 мл 1,0 н раствора
и 15 мл 1,0 н раствора 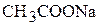 . Величина
. Величина 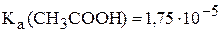 (считать, что при смешении растворов объём не изменяется).
(считать, что при смешении растворов объём не изменяется).
Решение. Концентрация ионов 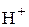 ацетатного буферного раствора вычисляется по уравнению
ацетатного буферного раствора вычисляется по уравнению
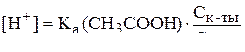 .
.
При этом отношение концентраций кислоты и соли будет равно отношению количеств этих веществ, т.е.
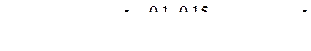 .
.
Следовательно, рН буферного раствора составит
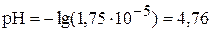 .
.
Примечание. Приведённые вычисления являются оценочными, так как они не учитывают различные побочные процессы (комплексообразование, протолиз ионов, их гидролиз и другие реакции).
Вариант 1
1. Вычислить величину рН, при которой начинается осаждение гидроксида магния из 0,01 М раствора 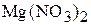 , если
, если 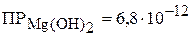 . (10,4)
. (10,4)
2. Вычислить величину 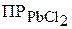 , если растворимость соли в воде составляет
, если растворимость соли в воде составляет 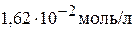 . (
. (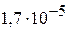 )
)
3. Вычислить массу ортофосфата лития, которая содержится в 3 л его насыщенного раствора. 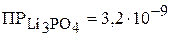 . (1,15 г)
. (1,15 г)
4. Вычислить рН раствора ацетатного буфера, полученного смешением 200 мл 0,2 н раствора уксусной кислоты и 15 мл 1 н раствора ацетата натрия. Величина 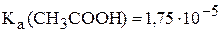 . Считать, что при смешении растворов объём не изменяется. (4,33)
. Считать, что при смешении растворов объём не изменяется. (4,33)
5. К 200 мл раствора уксусной кислоты, в котором степень её диссоциации равна 1,5 %, добавили ацетат натрия. При этом рН полученного буферного раствора стал равным 5,0. Вычислить массу ацетата натрия, которая была добавлена к раствору уксусной кислоты, если 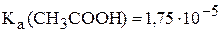 . (2,23 г)
. (2,23 г)
6. В каком объёмном соотношении необходимо смешать 0,2 М растворы аммиака и хлорида аммония, чтобы полученный буферный раствор имел рН 8? Величина 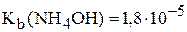 . Считать, что при смешении растворов объём не изменяется.
. Считать, что при смешении растворов объём не изменяется. 
Вариант 2
1. Вычислить величину рН, при которой начинается осаждение гидроксида алюминия из 0,01 М раствора 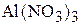 , если
, если 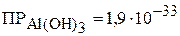 . Учитывая, что осаждение любого иона считается полным, если его концентрация в растворе уменьшается до
. Учитывая, что осаждение любого иона считается полным, если его концентрация в растворе уменьшается до 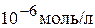 , вычислить значение рН раствора, при котором достигается полное осаждение ионов
, вычислить значение рН раствора, при котором достигается полное осаждение ионов 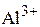 . (3,76; 5,09)
. (3,76; 5,09)
2. Смешали 250 мл 0,1 н раствора 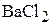 и 450 мл 0,004 н раствора
и 450 мл 0,004 н раствора 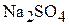 . Принимая диссоциацию солей в растворах полной, установить, выпадает ли осадок сульфата бария, если
. Принимая диссоциацию солей в растворах полной, установить, выпадает ли осадок сульфата бария, если 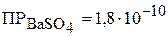 . (Выпадает)
. (Выпадает)
3. Произведение растворимости 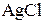 при 298 К равно
при 298 К равно 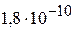 , а при 373 К составляет
, а при 373 К составляет 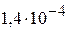 . Во сколько раз возросла растворимость хлорида серебра? (В 882 раза)
. Во сколько раз возросла растворимость хлорида серебра? (В 882 раза)
4. Вычислить рН буферного раствора, в 1 л которого содержится 0,2 моль уксусной кислоты и 0,02 моль ацетата калия. 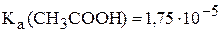 . (3,76)
. (3,76)
5. В каком объёмном соотношении необходимо смешать 0,1 н растворы уксусной кислоты и ацетата натрия, чтобы полученный буферный раствор имел значение pH 5? Считать, что при смешении растворов объём не изменяется. 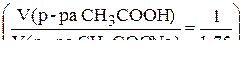
6. В 50 мл едкого кали (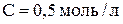 ) растворили 8,025 г хлорида аммония. Полученный раствор разбавили дистиллированной водой до объёма 0,5 л. Вычислить рН полученного раствора, если
) растворили 8,025 г хлорида аммония. Полученный раствор разбавили дистиллированной водой до объёма 0,5 л. Вычислить рН полученного раствора, если 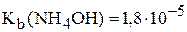 . Считать, что при смешении компонентов объём раствора не изменяется. (8,56)
. Считать, что при смешении компонентов объём раствора не изменяется. (8,56)
Вариант 3
1. Выпадет ли осадок, если смешать равные объёмы 0,01 н раствора 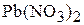 и 0,01 н раствора
и 0,01 н раствора 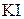 ?
? 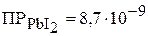 (считать, что соли полностью диссоциированы в растворе и объём при смешении растворов не изменяется). (Выпадает)
(считать, что соли полностью диссоциированы в растворе и объём при смешении растворов не изменяется). (Выпадает)
2. Вычислить равновесную молярную концентрацию ионов 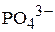 в насыщенном растворе ортофосфата магния, если
в насыщенном растворе ортофосфата магния, если  . (
. (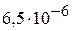 )
)
3. При какой минимальной концентрации бромид-ионов будет происходить превращение хлорида серебра в бромид серебра? 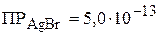 ,
, 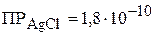 . (
. (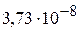 )
)
4. Как изменится рН раствора в результате добавления 1 мл 6 М раствора 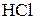 к 500 мл буферного раствора, полученного растворением 3,28 г ацетата натрия в 500 мл 0,1 М раствора уксусной кислоты? Величина
к 500 мл буферного раствора, полученного растворением 3,28 г ацетата натрия в 500 мл 0,1 М раствора уксусной кислоты? Величина 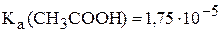 . В вычислениях пренебречь изменением объёма при смешении растворов. (pH изменится на 0,12)
. В вычислениях пренебречь изменением объёма при смешении растворов. (pH изменится на 0,12)
5. Как изменится величина рН буферного раствора, содержащего в 1 л 0,1 моль уксусной кислоты (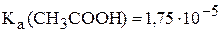 ) и 0,05 моль ацетата натрия, при его разбавлении в 10 раз? (Не изменится)
) и 0,05 моль ацетата натрия, при его разбавлении в 10 раз? (Не изменится)
6. Вычислить объёмы водных растворов муравьиной кислоты (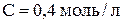 ) и формиата калия (
) и формиата калия (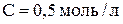 ), необходимые для приготовления буферного раствора объёмом 0,5 л с величиной рН 5. Считать, что смешение растворов происходит без изменения объёма. Величина
), необходимые для приготовления буферного раствора объёмом 0,5 л с величиной рН 5. Считать, что смешение растворов происходит без изменения объёма. Величина 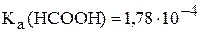 .
.
(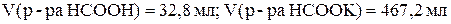 )
)
Вариант 4
1. 0,05 г 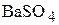 были промыты: а) 300 мл воды; б) 300 мл 0,02 М раствора
были промыты: а) 300 мл воды; б) 300 мл 0,02 М раствора 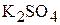 . Определить возможный процент потерь осадка вследствие растворимости соли (считать, что промывные воды насыщены сульфатом бария).
. Определить возможный процент потерь осадка вследствие растворимости соли (считать, что промывные воды насыщены сульфатом бария). 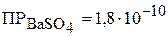 . (1,87 %;
. (1,87 %; 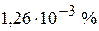 )
)
2. При 298 К 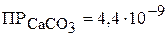 , а
, а 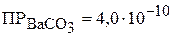 . Вычислить концентрации ионов
. Вычислить концентрации ионов 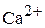 ,
, 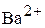 и
и 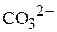 в растворе, насыщенном обеими солями.
в растворе, насыщенном обеими солями.
(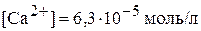 ;
; 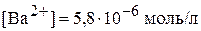 )
)
3. Вычислить рН насыщенного раствора гидроксида магния, если 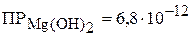 . (10,38)
. (10,38)
4. Какую минимальную и максимальную массу уксусной кислоты необходимо добавить к 4,00 г едкого натра, чтобы после растворения смеси в воде образовался буферный раствор? 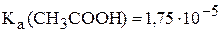 . При проведении расчётов учесть, что буферное действие раствора проявляется, если концентрация одного из компонентов, а, следовательно, и количество его вещества, превышает концентрацию другого не более, чем в 10 раз, т.е.
. При проведении расчётов учесть, что буферное действие раствора проявляется, если концентрация одного из компонентов, а, следовательно, и количество его вещества, превышает концентрацию другого не более, чем в 10 раз, т.е. 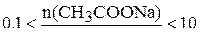 . (
. (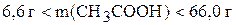 )
)
5. 3,28 г ацетата натрия было добавлено к 500 мл 0,1 М раствора уксусной кислоты. Вычислить рН полученного буферного раствора, если 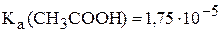 . (4,66)
. (4,66)
6. Фосфатный буферный раствор был приготовлен смешением 200 мл раствора дигидрофосфата натрия (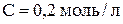 ) и 300 мл раствора гидрофосфата натрия (
) и 300 мл раствора гидрофосфата натрия (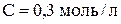 ). К полученному буферному раствору было добавлено 40 мл раствора NaOH (
). К полученному буферному раствору было добавлено 40 мл раствора NaOH (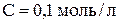 ). Вычислить рН исходного буферного раствора и раствора, полученного после добавления к нему водного раствора щёлочи. Величины
). Вычислить рН исходного буферного раствора и раствора, полученного после добавления к нему водного раствора щёлочи. Величины  и
и 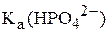 равны, соответственно,
равны, соответственно, 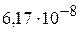 и
и 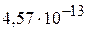 . Считать, что при смешении растворов объём не изменяется, а диссоциацией иона
. Считать, что при смешении растворов объём не изменяется, а диссоциацией иона 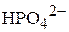 можно пренебречь, так как
можно пренебречь, так как  . (7,56; 7,63)
. (7,56; 7,63)
Вариант 5
1. Растворимость сульфата кальция при некоторой температуре составляет 0,0827 г соли в 100 мл раствора. Вычислить величину 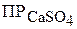 . (
. (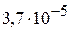 )
)
2. При каком соотношении концентраций ионов 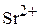 и
и 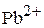 будет происходить совместное осаждение сульфатов стронция и свинца из водного раствора смеси их солей при добавлении к нему раствора
будет происходить совместное осаждение сульфатов стронция и свинца из водного раствора смеси их солей при добавлении к нему раствора 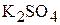 ?
? 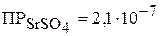 ;
; 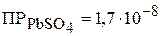 .
. 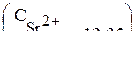
3. Вычислить массу хромата серебра в растворе хромата калия объёмом 300 мл (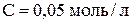 ), если
), если 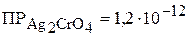 . (
. (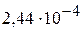 г)
г)
4. Раствор уксусной кислоты объёмом 100 мл смешали с 25 мл раствора гидроксида натрия (молярные концентрации раствора каждого электролита равны 0,5 моль/л), поместили в мерную колбу и разбавили дистиллированной водой до 1 л. Вычислить рН полученного раствора, если 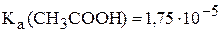 . (4,28)
. (4,28)
 2020-09-24
2020-09-24 653
653








