Кислые соли широко распространены. Например, пищевая сода – это кислая соль NaHCO3. При растворении кислой соли, образованной слабой кислотой, соперничают два процесса – диссоциация аниона и его гидролиз, например, для гидрокарбонат иона:
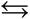 HCO3– H+ + CO32–
HCO3– H+ + CO32–
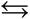 HCO3– + H2O H2CO3 + OH–
HCO3– + H2O H2CO3 + OH–
В заданиях ЕГЭ не требуется писать уравнения гидролиза, но нужно уметь определять среду в растворе кислой соли. Если преобладает диссоциация – в растворе избыток Н+, среда кислая, если преобладает гидролиз – в растворе избыток OH–, среда щелочная. Главным образом это зависит от силы кислоты, ее константы диссоциации. Константы диссоциации электролитов и расчет pH в школьную программу не входит, поэтому нужно запомнить:
Преобладает гидролиз и среда щелочная в растворах
гидрокарбонатов:
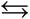 HCO3– + H2O H2CO3 + OH–
HCO3– + H2O H2CO3 + OH–
гидросульфидов:
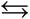 HS– + H2O H2S + OH–
HS– + H2O H2S + OH–
гидроортофосфатов:
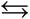 HPO3– + H2O H2PO4– + OH–
HPO3– + H2O H2PO4– + OH–
Преобладает диссоциация и среда кислая в растворах
гидросульфатов:
|
|
|
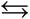 HSO4– H+ + SO42–
HSO4– H+ + SO42–
гидросульфитов:
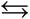 HSO3– H+ + SO32–
HSO3– H+ + SO32–
дигидроортофосфатов:
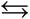 H2PO4– H+ + HPO42–
H2PO4– H+ + HPO42–
 2020-09-24
2020-09-24 412
412








