
| Название | —R |
| Глицин | —Н |
| Аланин | —СН3 |
| Цистеин | —CH2—SH |
| Серин | —CH2—ОН |
| Фенилаланин | —CH2—C6H5 |
| Тирозин | 
|
| Глутаминовая кислота | —CH2 —CH2 —СООН |
| Лизин | —(CH2)4—NH2 |
Все природные аминокислоты можно разделить на следующие основные группы:
1 ) алифатические предельные аминокислоты (глицин, аланин);
2) серосодержащие аминокислоты (цистеин);
3) аминокислоты с алифатической гидроксильной группой (серин);
4) ароматические аминокислоты (фенилаланин, тирозин);
5 ) аминокислоты с кислотным радикалом (глутаминовая кислота);
6) аминокислоты с основным радикалом (лизин).
Изомерия. Во всех a -аминокислотах, кроме глицина, a -углеродный атом связан с четырьмя разными заместителями, поэтому все эти аминокислоты могут существовать в виде двух изомеров, являющихся зеркальными отражениями друг друга.
Получение. 1. Гидролиз белковых веществ обычно дает сложные смеси аминокислот. Однако разработан ряд методов, позволяющих из сложных смесей получать отдельные чистые аминокислоты.
|
|
|
2. Замещение галогена на аминогруппу в соответствующих галогенокислотах. Этот способ получения аминокислот полностью аналогичен получению аминов из гало-генопроизводных алканов и аммиака:

Физические свойства. Аминокислоты представляют собой твердые кристаллические вещества, хорошо растворимые в воде и мало растворимые в органических растворителях. Многие аминокислоты имеют сладкий вкус. Они плавятся при высоких температурах и обычно при этом разлагаются. В парообразное состояние переходить не могут.
Химические свойства. Аминокислоты — это органические амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами. Аминокислоты реагируют как с кислотами, так и с основаниями:

При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:

Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей схемой:
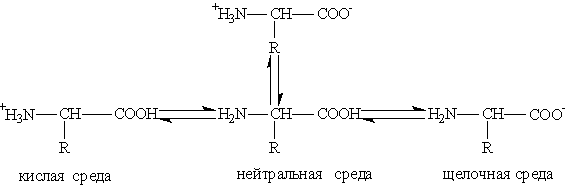
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. Так, глутаминовая кислота образует кислый раствор (две группы —СООН, одна —NH2), лизин — щелочной (одна группа —СООН, две —NH2).
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:

Важнейшее свойство аминокислот — их способность к конденсации с образованием пептидов.
|
|
|
Пептиды. Пептиды. — это продукты конденсации двух или более молекул аминокислот. Две молекулы аминокислоты могут реагировать друг с другом с отщеплением молекулы воды и образованием продукта, в котором фрагменты связаны пептидной связью —СО—NH —.

Полученное соединение называют дипептидом. Молекула дипептида, подобно аминокислотам, содержит аминогруппу и карбоксильную группу и может реагировать еще с одной молекулой аминокислоты:

Продукт реакции называется трипептидом. Процесс наращивания пептидной цепи может продолжаться в принципе неограниченно (поликонденсация) и приводить к веществам с очень высокой молекулярной массой (белкам).
Основное свойство пептидов — способность к гидролизу. При гидролизе происходит полное или частичное расщепление пептидной цепи и образуются более короткие пептиды с меньшей молекулярной массой или а-аминокислоты, составляющие цепь. Анализ продуктов полного гидролиза позволяет установить аминокислотный состав пептида. Полный гидролиз происходит при длительном нагревании пептида с концентрированной соляной кислотой.
Гидролиз пептидов может происходить в кислой или щелочной среде, а также под действием ферментов. В кислой и щелочной средах образуются соли аминокислот:

Ферментативный гидролиз важен тем, что протекает селективно, т. е. позволяет расщеплять строго определенные участки пептидной цепи.
Качественные реакции на аминокислоты. 1) Все аминокислоты окисляются нингидрином с образованием продуктов, окрашенных в сине-фиолетовый цвет. Эта реакция может быть использована для количественного определения аминокислот спектрофотометрическим методом. 2) При нагревании ароматических аминокислот с концентрированной азотной кислотой происходит нитрование бензольного кольца и образуются соединения, окрашенные в желтый цвет. Эта реакция называется ксантопротеиновой (от греч. ксантос — желтый).
Белки. Белки — это природные полипептиды с высокими значениями молекулярной массы (от10 000 до десятков миллионов). Они входят в состав всех живых организмов и выполняют разнообразные биологические функции.
Строение. Можно выделить четыре уровня в строении полипептидной цепи. Первичная структура белка — это конкретная последовательность аминокислот в полипептидной цепи. Пептидная цепь имеет линейную структуру только у небольшого числа белков. В большинстве белков пептидная цепь определенным образом свернута в пространстве.
Вторичная структура — это конформация полипептидной цепи, т. е. способ скручивания цепи в пространстве за счет водородных связей между группами NH и СО. Основной способ укладки цепи — спираль.
Третичная структура белка — это трехмерная конфигурация закрученной спирали в пространстве. Третичная структура образуется за счет дисульфидных мостиков —S—S— между цистеиновыми остатками, находящимися в разных местах полипептидной цепи. В образовании третичной структуры участвуют также ионные взаимодействия противоположно заряженных групп NH3+ и СОО- и гидрофобные взаимодействия, т. е. стремление молекулы белка свернуться так, чтобы гидрофобные углеводородные остатки оказались внутри структуры.
Третичная структура — высшая форма пространственной организации белков. Однако некоторые белки (например, гемоглобин) имеют четвертичную структуру, которая образуется за счет взаимодействия между разными полипептидными цепями.
Физические свойства белков весьма разнообразны и определяютсяих строением. По физическим свойствам белки делят на два класса: глобулярные белки растворяются в воде или образуют коллоидные растворы, фибриллярные белки в воде нерастворимы.
|
|
|
Химические свойства. 1. Разрушение вторичной и третичной структуры белка с сохранением первичной структуры называют денатурацией. Она происходит при нагревании, изменении кислотности среды, действии излучения. Пример денатурации — свертывание яичных белков при варке яиц. Денатурация бывает обратимой и необратимой. Необратимая денатурация может быть вызвана образованием нерастворимых веществ при действии на белки солей тяжелых металлов — свинца или ртути.
2. Гидролиз белков — это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот. Анализируя продукты гидролиза, можно установить количественный состав белков.
3. Для белков известно несколько качественных реакций. Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе. Эта реакция называется биуретовой. Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты (ксантопротеиновая реакция).
Биологическое значение белков:
1. Абсолютно все химические реакции в организме протекают в присутствии катализаторов — ферментов. Все известные ферменты представляют собой белковые молекулы. Белки — это очень мощные и селективные катализаторы. Они ускоряют реакции в миллионы раз, причем для каждой реакции существует свой единственный фермент.
2. Некоторые белки выполняют транспортные функции и переносят молекулы или ионы в места синтеза или накопления. Например, содержащийся в крови белок гемоглобин переносит кислород к тканям, а белок миоглобин запасает кислород в мышцах.
3. Белки — это строительный материал клеток. Из них построены опорные, мышечные, покровные ткани.
4. Белки играют важную роль в иммунной системе организма. Существуют специфические белки (антитела), которые способны распознавать и связывать чужеродные объекты — вирусы, бактерии, чужие клетки.
5. Белки-рецепторы воспринимают и передают сигналы, поступающие от соседних клеток или из окружающей среды. Например, действие света на сетчатку глаза воспринимается фоторецептором родопсином. Рецепторы, активизируемые низкомолекулярными веществами типа ацетилхолина, передают нервные импульсы в местах соединения нервных клеток.
|
|
|
Из приведенного перечня функций белков ясно, что белки жизненно необходимы любому организму и являются, следовательно, важнейшей составной частью продуктов питания. В процессе пищеварения белки гидролизуются до аминокислот, которые служат исходным сырьем для синтеза белков, необходимых данному организму. Существуют аминокислоты, которые организм не в состоянии синтезировать сам и приобретает их только с пищей. Эти аминокислоты называют незаменимыми.
Углеводы
Углеводами называют природные органические соединения, имеющие, как правило, общую формулу СmН2nОn (Сm(Н2O)n), где т и n ³ 3. Исключение составляют дезоксисахара, которые имеют общую формулу СmН2п+2On.
В зависимости от способности к гидролизу все углеводы делятся на:
моносахариды — углеводы, молекулы которых не подвержены гидролизу;
олигосахариды — углеводы, из молекул которых при гидролизе образуется от двух до десяти одинаковых или различных моносахаридов;
полисахариды — углеводы, из молекул которых при гидролизе образуется от десятков тысяч и выше одинаковых или различных моносахаридов.
Углеводы — распространенный в природе класс органических соединений.
В растениях углеводы образуются в результате реакции фотосинтеза из CO2 и Н2О:

Моносахариды. Моносахариды по числу углеродных атомов в молекуле делятся на: триозы (С3Н6О3), тетрозы (С4Н8О4), пентозы (С5Н10О5), гексозы (С6Н12О6), гептозы (С7Н14О7) и октозы (С8Н16О8).
Моносахариды — дифункциональные соединения, так как в составе каждой молекулы содержатся несколько гидроксильных групп и одна карбонильная. В зависимости от природы карбонильной группы (альдегидная или кетонная) моносахариды делятся на альдозы и кетозы. Так, моносахарид гексоза существует в виде двух структурных изомеров — альдогексозы (I) (глюкоза) и кетогексозы (II) (фруктоза):

Изомерия моносахаридов обусловлена: 1) наличием альдегидной или кетонной группы; 2) наличием асимметрических атомов углерода; 3) существованием таутомерии.
Моносахариды, как и другие соединения с асимметрическими атомами углерода, существуют в виде двух оптических изомеров — D- и L-форм. Отнесение к D- и L-формам производят по расположению гидроксильной группы у атома углерода, соседнего с первичной спиртовой группировкой:

Все моносахариды существуют в виде двух таутомерных форм: открытой, или ациклической, и закрытой, или циклической. Циклическая форма образуется в результате внутримолекулярного взаимодействия альдегидной (кетонной) группировки с одним из гидроксидов (см. “Альдегиды и кетоны”).
Наибольшей устойчивостью обладают шести- и пятичленные циклы, называемые соответственно пиранозными и фуранозными циклами. Схема образования пиранозного цикла:

Атом водорода гидроксильной группы присоединяется к атому кислорода альдегидной группировки за счет разрыва p -связей. При этом образуется так называемый полуацетальный (см. “Альдегиды и кетоны”) или гликозидный гидроксил. После переноса атома водорода от гидроксильной группы на альдегидную атом кислорода соединяется с атомом углерода с образованием цикла. В результате циклизации в молекуле моносахарида появляется дополнительный асимметрический атом углерода.
Образующиеся циклические формы отличаются друг от друга расположением полуацетального гидроксила. К a -изомерам относят моносахариды, у которых гликозидный гидроксил находится под плоскостью кольца, к b -изомерам — моносахариды, у которых полуацетальный гидроксил находится над плоскостью кольца.
Получение: 1. Выделение моносахаридов, встречающихся в овощах и фруктах. 2. Гидролиз полисахаридов. 3. Синтез гексоз из формальдегида:

Реакция была впервые изучена А. М. Бутлеровым. В результате реакции образуется смесь различных трудноразделяемых гексоз.
Физические свойства. Моносахариды — бесцветные кристаллические вещества, плавящиеся с разложением, хорошо растворимые в воде, в растворах вращающие поляризованный свет, сладкие на вкус.
Химические свойства. Многообразие химических свойств моносахаридов объясняется их дифункциональностью.
1. Реакции образования эфиров. Моносахариды способны образовывать простые и сложные эфиры. Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила:

Простые эфиры получили название гликозидов. В более жестких условиях возможно алкилирование и по другим оставшимся гидроксильным группам.
Моносахариды способны образовывать сложные эфиры как с минеральными, так и с карбоновыми кислотами, например:

Большое значение имеют эфиры фосфорной кислоты рибозы и дезоксирибозы, являющиеся структурными фрагментами РНК и ДНК (см. “Азотсодержацие соединения”).
2. Реакция комплексообразования с гидроксидом меди (II). При взаимодействии свежеосажденного гидроксида меди (II) с моносахаридами происходит растворение гидроксида с образованием комплекса синего цвета (см. “Спирты. Фенолы”).
3. Окислительно-восстановительные реакции (ОВР). При каталитическом гидрировании моносахаридов происходит восстановление карбонильной группы до спиртового гидроксила:

Бромная вода окисляет альдегидную группировку до карбоксильной:

ОВР с оксидом серебра (I) и гидроксидом меди (II) используют как качественные реакции на альдозы и кетозы:


Кетозы дают те же самые реакции, так как в щелочной среде происходит их изомеризация в альдозы.
4. Реакция брожения. Моносахариды (например, глюкоза) способны расщепляться в зависимости от природы фермента до этанола, масляной или молочной кислоты:

Отдельные моносахариды. Глюкоза — бесцветное кристаллическое вещество, сладкое на вкус, хорошо растворимое в воде.
В организме человека и животных глюкоза подвергается ферментативному окислению, конечными продуктами которого являются оксид углерода(IV) и вода:

Фруктоза — структурный изомер глюкозы. Кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза. В свободном виде содержится в мёде и фруктах.
Химические свойства фруктозы обусловлены наличием кетонной и пяти гидроксильных групп.
Дезоксирибоза — бесцветное кристаллическое вещество, хорошо растворимое в воде. В виде фуранозной формы входит в состав ДНК. Как и другие моносахариды, дезоксирибоза в растворе существует в ациклической и циклической формах, способна образовывать простые и сложные эфиры, принимает участие в ОВР и реакциях комплексообразования.

Рибоза — бесцветное кристаллическое вещество, хорошо растворимое в воде. В виде фуранозной формы входит в состав РНК. Химические свойства рибозы обусловлены наличием альдегидной и гидроксильных групп. При восстановлении рибозы образуется спирт — рибит НОСН2—(СНОН)3—СН2ОН, а при окислении — рибоновая кислота НОСН2—(СНОН)3—СООН. В растворе рибоза существует в ациклической и циклической формах:

Получают рибозу гидролизом мононуклеотидов.
Олигосахариды. Наиболее изученными олигосахаридами являются дисахариды, которые широко распространены в природе. Они содержатся во многих плодах и овощах, сахарной свекле, сахарном тростнике, меде.
Получение. Дисахариды получают из природных источников: сахарозу из сахарной свеклы или сахарного тростника, мальтозу — ферментативным гидролизом крахмала, лактозу — из коровьего молока, целлобиозу — гидролизом целлюлозы.
Физические свойства. Дисахариды — бесцветные кристаллические вещества, хорошо растворимые в воде (исключение составляет лактоза), сладкие на вкус. Различают два вида дисахаридов.
1. Простые эфиры (гликозиды), образующиеся за счет взаимодействия полуацетального гидроксила одной из молекул моносахарида и одного из спиртовых гидроксилов (чаще всего у четвертого атома углерода) другой молекулы:

Молекула образующегося при этом дисахарида содержит один полуацетальный гидроксил и способна переходить в ациклическую альдегидную форму. Подобные дисахариды способны восстанавливать такие вещества, как Ag2O, Cu(OH)2, за что их называют восстанавливающими сахарами.
К восстанавливающим сахаром относятся также целлобиоза и лактоза:


2. Простые эфиры образуются за счет взаимодействия двух полуацетальных гидроксилов:

Дисахариды этого типа не дают реакцию “серебряного зеркала” и не восстанавливают гидроксид меди (II), поэтому их называют невосстанавливающими сахарами.
Дисахариды, как и моносахариды, способны образовывать простые и сложные эфиры.
Характерной особенностью дисахаридов является их способность взаимодействовать с гидроксидами металлов Са(ОН)2, Сu(ОН)2 с образованием хорошо растворимых комплексных соединений сахаратов (см. “Спирты. Фенолы”).
В кислой среде дисахариды легко гидролизуются с образованием одинаковых (мальтоза, целлобиоза) или различных (лактоза, сахароза) моносахаридов (см. выше).
Полисахариды. Общая формула полисахаридов, образованных остатками пентоз (C5H8О4)n, гексоз(C6H10О5), где n = 103 - 105. Наибольшее значение имеют производные глюкозы: крахмал и целлюлоза.
Крахмал является основным компонентом картофеля (20—24%), кукурузы (50—70%), пшеницы (» 70%), риса (» 80%).
Целлюлоза является главной составной частью древесины (» 50%), льна (» 80%), хлопка (90—97%).
Крахмал — белый порошок, нерастворимый в холодной воде, в горячей воде набухает, образуя крахмальный клейстер. Крахмал состоит из двух фракций: амилозы (15—25%) и амилопектина (75—85%).
Амилоза представляет собой линейный биополимер, состоящий из остатков глюкозы, соединенных через кислородные атомы в положении 1 и 4. Молекулярная масса амилозы от 150 000 до 500 000 а. е. м. в зависимости от вида растения.

Амилопектин — это биополимер, состоящий из остатков глюкозы, соединенных через кислородные атомы в положении 1—4 и 1—6. Молекулярная масса амилопектина составляет порядка миллиона а. е. м.
Характерным признаком крахмала является его способность последовательно гидролизоваться:

Крахмал не дает реакцию “серебряного зеркала” и не восстанавливает гидроксид меди (II).
Характерным свойством крахмала является образование с раствором иода комплекса, имеющего синюю окраску.
Получают крахмал из природных крахмалосодержащих продуктов, чаще всего картофеля и кукурузы. Он широко используется в качестве продукта питания, а также как сырье для производства глюкозы и этилового спирта.
Целлюлоза — белый волокнистый материал, нерастворимый в воде; имеет такой же элементный состав, как и крахмал. Различие между целлюлозой и крахмалом заключается в том, что: 1) в первом случае остатки глюкозы соединены b -гликозидной связью, а во втором — a -гликозидной связью; 2) в случае целлюлозы молекула имеет линейную форму, а в случае крахмала — форму трехмерной частицы; 3) молекулярная масса целлюлозы от 106 до 109 а.е.м.
Целлюлоза способна образовывать простые (метилцеллюлоза) и сложные (нитроцеллюлоза, ацетилцеллюлоза) эфиры. Так как каждое звено молекулы целлюлозы (так же, как и крахмала) содержит три гидроксильные группы, то возможные ее сложные эфиры с азотной и уксусной кислотами можно выразить следующими формулами:
[C6H7O2(OH)2ONO2]n [C6H7O2(OH)(ONO2)2]n
мононитроцеллюлоза динитроцеллюлоза
[C6H7O2 (ONO2)3]n [C6H7O2(OH)2OСOСH3]n
тринитроцеллюлоза моноацетилцеллюлоза
[C6H7O2 (OH)(OСOСH3)2]n [C6H7O2(OСOСH3)3]
диацетилцеллюлоза триацетилцеллюлоза
Целлюлоза, подобно крахмалу, в кислой среде гидролизуется:

Получают целлюлозу путем “варки” (нагревание под давлением) измельченной древесины с гидросульфитом кальцияСа(НSO3)2.
Целлюлоза широко применяется для изготовления бумаги, ее ацетатные производные — для изготовления пленок (целлофан), искусственного шелка, нитропроизводные — для изготовления бездымного пороха (тринитроцеллюлоза — пироксилин).
 2020-10-10
2020-10-10 116
116







