Растворы электролитов являются проводниками второго рода, в которых заряд переносится ионами: в отличие от проводников первого рода (металлы) с электронной проводимостью. Движение ионов в растворе электролита при прохождении через электролит электрического тока связано с преодолением ионами сопротивление раствора. Поэтому способность растворов электролитов пропускать электрический ток можно характеризовать величиной их удельного электрического сопротивления.
Удельным сопротивлением S называется сопротивление столбика вещества длиной в 1 см при поперечном сечении 1см2. Если проводник длиной в l см с поперечным сечением S (см2) обладает мощным сопротивлением R, удельное сопротивление r проводника определяется соотношением:
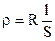 , Ом×см.
, Ом×см.
В электрохимии способность растворов пропускать электрический ток принято характеризовать величиной, обратной сопротивлению и называемой электропроводностью. По аналогии с удельным сопротивлением можно ввести понятие удельной электропроводности Ом-1см-1:
|
|
|
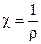 .
.
В качестве единицы электропроводности в системе единиц СИ принят 1 сименс = 1 См = 1 Ом-1 – проводимость раствора, а в качестве единицы удельной электропроводности принято См×м-1. Связь между общим сопротивлением раствора и его электропроводностью нетрудно найти, сопоставив уравнения:
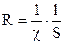 .
.
Если обозначить величину общей электропроводности раствора К, то зависимость c от К можно записать:
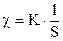 .
.
 2014-02-04
2014-02-04 530
530








