Геохимическая классификация природных вод
Миграция химических элементов в природных водах зависит от большого числа факторов - температуры, окислительно - востановительной обстановки, кислотно - основных свойств, ионного состава вод и т. д.
Интенсивность миграции химических элементов в гидросфере резко возрастает при переходе их в растворимое состояние. Этот переход осуществляется в результате растворения природных химических соединений (минералов) в воде. Процесс растворения минералов сопровождается появлением в природных водах химических элементов в виде ионов - катионов или анионов. Соединения некоторых элементов (например, кремний Si) образуют молекулярные растворы, без заметной диссоциации молекул на ионы. Другой важной формой миграции элементов в гидросфере является миграция в коллоидном состоянии (коллоидные растворы). Коллоидные растворы - гетерогенные системы, в которых мелкодисперсная твердая фаза распределена в жидкой дисперсионной среде. Размеры коллоидных частиц малы (10-6 - 10-7 м), поэтому вследствие теплового (броуновского) движения их осаждение не происходит и такие системы длительное время могут быть устойчивы, без разделения на жидкую и твердую фазу.
Растворение минералов - обратимый процесс и при изменении внешних условий (концентрация ионов водорода, окислительно - восстановительная обстановка, температура, давление) происходит выделение из растворов нерастворимых в данных условиях химических соединений.
В условиях земной поверхности растворимость минералов, кроме их химических свойств, определяется чаще всего кислотно - основными и окислительно - восстановительными условиями природных вод, контактирующих с этими минералами.
Количественно кислотно - основные свойства характеризуются величиной водородного показателя (рН), представляющего собой отрицательный десятичный логарифм концентрации ионов водорода в растворе. Значение рН, меньшее 7 свидетельствует о кислом характере раствора, при рН, большем 7 раствор является щелочным.
Для характеристики окислительно - восстановительных условий используется величина окислительного потенциала (Еh), являющаяся электро - химической характеристикой окислительно - восстановительной реакции. По своему физическому смыслу Eh - это разность потенциалов между двумя электродами, на одном из которых протекает окислительно-восстановительная реакция, а на другом (стандартном) - реакция восстановления водорода (2Н+ + 2е Þ Н2). Потенциал водородного электрода условно принят за нулевой. Величина Eh измеряется в вольтах и может иметь как положительное, так и отрицательное значение. Положительные значения Eh характеризуют окислительную обстановку, отрицательные - восстановительную.
В настоящее время созданы чувствительные измерительные электроды, позволяющие быстро и точно определять значения рН и Eh природных и техногенных вод, почв, донных отложений. Обобщенные данные многочисленных экспериментальных исследований кислотно - основных и окислительно - восстановительных свойств различных объектов биосферы приведены на рис. 2.1 [28].
На рис. 2.1. видно, что окислительная обстановка может создаваться только в поверхностных водах при условии хорошей циркуляции и контакте с атмосферой. При прекращении контакта с атмосферой и при наличии органических остатков окислительная способность вод быстро исчезает, в них формируется восстановительная обстановка (болотные почвы, морские осадки). Разложение органических веществ под действием микроорганизмов приводит не только к появлению восстановительной обстановки, но и к увеличению кислотности среды за счет образования угольной кислоты Н2СО3 и сероводорода Н2S.
Снижение кислотности вод связано обычно с увеличением их минерализации (гидролиз растворенных силикатов и карбонатов). К примеру, снижение кислотности в ряду: дождевые воды - речные воды - грунтовые воды.
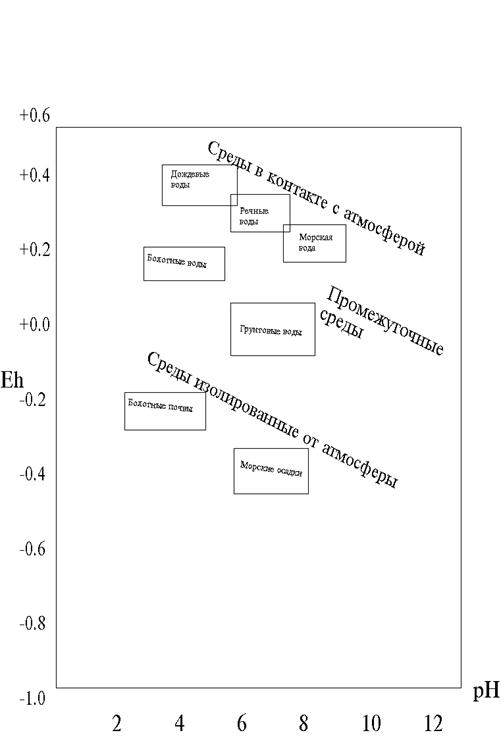
Рис. 2.1. Значение рН и Еh для некоторых природных сред.
По современной классификации природных вод (рис.2.2)[2] самой крупной единицей классификации является группа вод. Выделяют 4 группы:
1. Холодные и слаботермальные воды верхней части земной коры. Это воды зоны гипергенеза и биосферы с температурой не более 50 оС.
2. Горячие и умеренно перегретые с температурой 50 - 200 оС.
3. Сильно перегретые с температурой 200 - 375 оС.
4. Флюидные с температурой свыше 375 оС
Выделение температуры как основного фактора самой крупной классификационной единицы связано с тем, что температура определяет формы существования материи, условия миграции атомов, формы нахождения элементов, скорости прохождения химических реакций. Четко выделяется группа холодных и слаботермальных вод, в которых возможна энергичная бактериальная деятельность. Современное состояние знаний позволяет разработать подробную геохимическую классификацию только для первой группы вод.
В пределах первой группы вод наибольшие геохимические различия связаны с окислительно-восстановительной обстановкой. Большое ее значение объясняется огромным энергетическим эффектом окислительно - восстановительных реакций, коренным образом меняющих геохимическую обстановку в природных водах.
Выделяют 3 типа вод:
· кислородные;
· глеевые;
· сероводородные.
К первой группе относятся воды, содержащие свободный кислород. Появление свободного кислорода в этих водах связано с его растворимостью при контакте с атмосферным воздухом, выделением кислорода в процессе фотосинтеза водных растений. В подземных водах появление свободного кислорода связано с разложением воды на водород и кислород под влиянием радиоактивных излучений - радиолизом воды.
Ко второму типу относятся глеевые воды, характеризующиеся отсутствием свободного кислорода. Глеевые воды образуются в районах тундровых болот, тайги, влажных тропиков, где большое количество разлагающихся растительных остатков и высокая увлажненность почвенного слоя препятствуют насыщению вод кислородом. В этих условиях разложение растительных остатков происходит под действием анаэробных бактерий, которые для своей жизнедеятельности потребляют кислород из минеральных соединений химических элементов, переводя их в восстановленную форму.
Сероводородные воды характеризуются восстановительной обстановкой. Они формируются в таких же условиях, что и глеевые воды, но при достаточно высоком содержании анионов сульфата. В процессе жизнедеятельности анаэробных бактерий происходит восстановление серы и в воде появляются анионы сульфида и гидросульфида.
В пределах типов геохимические различия вод в первую очередь определяются кислотно-щелочными условиями.
По ним выделяют 4 класса вод:
· сильнокислые с рН < 3 - 4;
· слабокислые с рН от 4 до 6.5;
· нейтральные и слабощелочные с рН от 6.5 до 8.5;
· сильнощелочные с рН > 8.5.
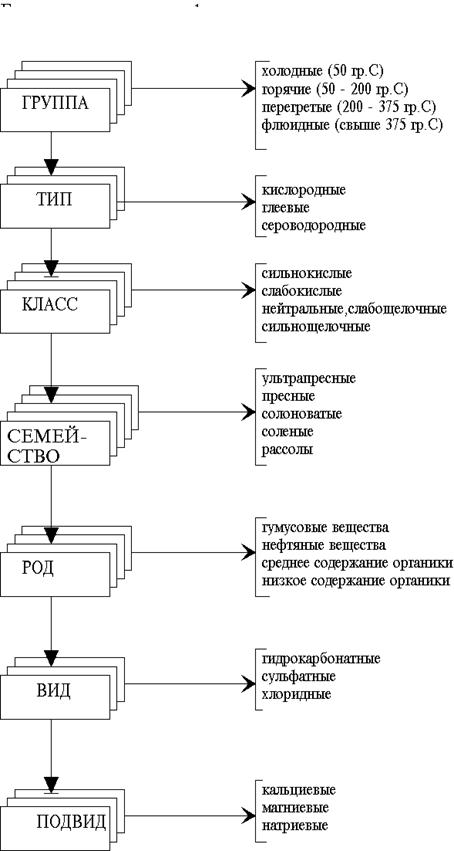
Рис. 2.2. Геохимическая классификация природных вод.
Воды сильнокислого класса распространены сравнительно мало. Они известны в районах сульфидных месторождений, где окисление сульфидов, в первую очередь пирита, приводит к формированию сернокислых вод, имеющих не только низкий рН, но и обогащенных металлами. В таких районах встречаются сернокислые ("купоросные ") озера. Одно из подобных озер расположено вблизи Гайского медноколчеданового месторождения на Южном Урале.
Сернокислые ручьи и речки характерны и для районов некоторых угольных шахт - водоотлив шахтных вод и подотвальные воды, кислотность которых связана с окислением содержащегося в угле пирита.
В районах современного вулканизма (Курилы, Япония, Индонезия) формируются сильнокислые термальные подземные воды, а в местах их выхода на поверхность - кислые реки. Кислотность таких вод связана с растворением в них хлористого водорода и других вулканических газов.
Воды слабокислого класса формируются в районах изверженных и других пород, не содержащих растворимых минеральных компонентов (карбонатов, гипса и т.д.). Формирование химического состава вод протекает в почвах при разложении растительных остатков. Концентрация иона водорода, а следовательно и кислотность связаны с растворенной угольной кислотой и органическими кислотами, образующимися при разложении растительных остатков. Такие воды обычно содержат мало растворенных минеральных веществ, по составу - гидрокарбонатно - кальциевые (ведущие ионы Са2+ и НСО3-). Эти воды обычно богаты растворенными органическими веществами, в связи с чем имеют темный цвет. Под защитой органических веществ, в виде комплексных соединений в них хорошо мигрируют многие металлы.
Воды нейтрального и слабощелочного класса формируются в районах карбонатных пород. Здесь наряду с процессами разложения растительных остатков и появления в водах органических кислот и углекислоты идут процессы растворения карбонатных минералов (обычно карбоната кальция СаСО3), приводящие к нейтрализации вод. Такие воды обычно распространены очень широко в различных климатических зонах, характеризуются повышенной минерализацией и относительно небольшим количеством растворенных органических веществ.
Воды сильнощелочного класса наиболее характерны для районов засушливого климата и обязаны своей щелочной реакцией содержащейся в них соде - бикарбонату NaHCO3, реже карбонату Na2CO3 натрия. Содовые воды довольно распространены на земле обычно в виде озер - содовые озера Западной Сибири, Восточной Африки, Калифорнии. Подземные содовые воды обычно приурочены к нефтегазовым месторождениям.
В целом в верхней части земной коры преобладают слабощелочные и нейтральные воды (океанические, речные и грунтовые). Менее распространены слабокислые и еще меньше сильнокислые и сильнощелочные.
В пределах классов воды разделяются на семейства по величине общей минерализации (количеству растворенных веществ):
· ультрапресные, минерализация до 0.1 г/л;
· пресные, минерализация до 1.5 г/л;
· солоноватые, минерализация от 1.5 до 10 г/л;
· соленые, минерализация от 10 до 40 г/л;
· рассольные, минерализация более 40 г/л.
Ультрапресные воды широко распространены в природе, к ним относятся многие атмосферные осадки, поверхностные и грунтовые воды материков в районах влажного климата, в частности, многие реки Восточной Сибири и Дальнего Востока. Ультрапресные воды не насыщены практически всеми минеральными соединениями и обладают большой растворяющей спосбностью.
Пресные воды характерны для большинства рек и озер влажного климата, многих грунтовых вод. Эти воды составляют главную базу питьевого и технического водоснабжения.
Солоноватые воды широко распространены в степях, пустынях и сухих саваннах, в артезианских бассейнах подземных вод. Они насыщены СаСО3, MgCO3 и частично CaSO4. Растворяющая способность вод этих слабее, чем пресных.
К соленым водам относятся воды морей и океанов, а также соленых озер. Это самые распространенные воды в биосфере. Растворяющая способность этих вод низкая.
Рассольные воды характерны для некоторых соленых озер и глубоких подземных вод изверженных пород. Среди этих вод преобладают хлоридные растворы.
По содержанию органических веществ все природные воды делятся на 4 рода:
1. Bоды, богатые растворенными органическими веществами гумусового ряда. К ним относятся воды таежных, тундровых, тропических болот, рек и озер. Для них характерно большое количество гумусовых кислот, придающих водам коричневую окраску.
2. Воды, богатые растворенными органическими соединениями нефтяного происхождения. Они характерны для сопутствующих подземных вод нефтегазовых месторождений. В составе растворенных органических веществ преобладают низкомолекулярные жирные кислоты, нафтеновые кислоты, фенолы, бензол, толуол.
3. Воды, средние по содержанию органических веществ - океанические воды.
4. Воды, бедные по содержанию растворенных органических веществ. К ним относятся воды горных рек и озер, воды засушливых ландшафтов.
По ионному составу воды классифицируются на следующие виды:
по преобладающему аниону (вид):
· гидрокарбонатные;
· сульфатные;
· хлоридные;
по преобладающему катиону (подвид):
· кальциевые;
· магниевые;
· натриевые.
Часто для описания химического состава поверхностных и подземных вод применяется формула М.Г.Курлова, характеризующая минерализацию вод и их ионный состав.
Миграция химических элементов в природных водах в растворенной форме зависит от окислительно-восстановительных и кислотно-щелочных условий. Это связано с различной растворимостью соединений элементов в разных степенях окисления (окислительно-восстановительные условия) и зависимостью их растворимости от концентрации ионов Н+ и ОН- (кислотно-основные условия).
Растворение минералов и перевод части их химических элементов в растворимое состояние связано с процессами их физико-химического и биохимического разложения при непосредственном участии воды. Количественно способность элементов переходить в растворенное состояние и мигрировать в растворенном виде, оценивается коэффициентом водной миграции [1,14]:
Мх ×100
Кх = ¾¾¾¾¾¾,
а × Сх
где Мх - содержание элемента в воде, г/л
а - минерализация воды (а = 0.43 г/л)
Сх - содержание элемента в водовмещающих породах, %
По величине Кх все химические элементы можно классифицировать по интенсивности миграции в коре выветривания биосферы:
очень сильные мигранты Kx > 10
S, Cl, B, Br, I
сильные мигранты Kx = 10 - 1
Ca, Na, Mg, F, Sr, Zn, U, Mo, Se
средниe мигранты Kx = 1 - 0.1
Si, K, Mn, P, Ba, Rb, Ni, Cu, Li, Co, Cs, As, Tl, Ra
слабые мигранты Kx < 0.1
Al, Fe, Ti, Zr, V, Nb, Th, Be, Ta, Sn, Hf, Y, Pt
К элементам, которые подвижны в водах любого состава и при любых кислотно-основных и окислительно-восстановительных условиях, относятся натрий Na, калий К, рубидий Rb, цезий Cs, хлор Cl, бром Br, иод I.
Для кислородных вод характерна миграция большинства химических элементов в кислых и слабокислых водах.
В сильнокислых сернокислых водах легко мигрирует большинство металлов, в том числе алюминий, железо, медь, цинк и др. Типоморфными в таких водах являются ионы Н+, Fe2+, Cu2+, Zn2+, Al3+.В сильнокислых водах не мигрируют барий Ва, стронций Sr, серебро Ag, золото Au, селен Se, теллур Те, сурьма Sb. Это объясняется следующими причинами. Сильнокислые воды содержат свободную серную кислоту, образующую нерастворимые сульфаты с частью перечисленных элементов (Ba, Sr, Ag). Кроме того, окислительная обстановка и сильнокислая среда приводит к образованию нерастворимых селеновой, теллуровой и сурьмьяной кислот.
В слабокислых водах легко мигрируют металлы в форме бикарбонатов и комплексных соединений с органическими кислотами. Типоморфными для этих вод являются ионы Н+ и часто Fe2+.
Нейтральные и слабощелочные воды менее благоприятны для миграции большинства металлов, которые в таких водах осаждаются в форме нерастворимых гидроксидов, карбонатов и других солей. Анионогенные элементы, наоборот, мигрируют сравнительно легко (селен, уран, молибден, сурьма, кремний, теллур и т.д.).
Для сильнощелочных вод характерно, что в них практически не мигрируют железо, кальций, магний, стронций и большинство других металлов, но интенсивно мигрируют анионогенные элементы - кремний, селен, молибден, уран. Однако, для сильнощелочных вод наблюдается миграция ряда элементов в виде комплексных анионов: [Cu(CO3)]2-, AlO2-. Скандий, иттрий, цирконий, не мигрирующие в слабокислых и нейтральных водах, в сильнощелочных образуют растворимые карбонатные комплексы. Типоморфными для сильнощелочных вод являются катион натрия, ион гидроксида, иногда кремний.
Сероводородные воды являются средой, крайне неблагоприятной для миграции большинства химических элементов, образующих нерастворимые сульфиды.
 2014-02-05
2014-02-05 6580
6580








