Основные выводы.
1. Термодинамика — раздел физики, поучающий наиболее общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия и процессы перехода между этими состояниями. Состояние определяется параметрами системы: объемом, температурой, давлением, внутренней энергией и т.д. Состояние называется равновесным, если все его параметры имеют определенное значение и остаются неизменными при неизменных внешних условиях.
Обратимый процесс —это процесс, который протекает достаточно медленно, так что его можно рассматривать как последовательный переход от одного равновесного состояния к другому, причем этот процесс можно провести в обратном направлении без изменения совершенной работы и переданного количества теплоты.
2. Внутренняя (или тепловая) энергия U —это полная сумма всех видов энергии всех молекул, принадлежащих данному телу. Для одноатомного идеального газа:
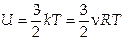 .
.
3. Теплота — это способ передачи энергии от одного тела к другому благодаря разнице температур. Единица измерения теплоты 1 калория — это количество теплоты, необходимое для повышения температуры 1 г воды на 1°С, а именно от 14,5°С до 15,5°С.
Поскольку теплота как и работа — способ передачи энергии, то определенное количество работы всегда эквивалентно определенному количеству теплоты. Механический эквивалент теплоты: 1 кал = 4,184 Дж.
4. Первое начало термодинамики — это иная формулировка закона сохранении энергии:
Если два тела или системы с разными температурами привести в тепловой контакт, то возникает «поток» теплоты D Q от более горячего тела к более холодному. Поступившая в систему теплота должна быть равна сумме приращений внутренней энергии D U и работы D А, совершаемой системой над внешними телами: D Q = D U + D А.
5. Количество теплоты, передаваемой телу, пропорционально массе вещества m и изменению температуры D Т: D Q = cm D Т. Коэффициент пропорциональности с называется удельной теплоемкостью и является характеристикой данного вещества. Теплоемкость одного моля вещества С называется молярной теплоемкостью.
Теплоемкость одноатомного идеального газа при постоянном объеме равна 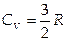 .
.
Теплоемкость такого же газа при постоянном давлении равна Ср = СV + R.
6. Второе начало термодинамики определяет, какие процессы возможны в природе, а какие — нет. Одна из формулировок второго начала:
Теплота в естественных условиях переходит от горячего тела к холодному, в то время как от холодного тела к горячему теплота сама по себе не переходит.
7. Тепловая машина — это устройство, преобразующее тепловую энергию в механическую. В тепловом двигателе механическая работа может быть получена при переходе теплоты из области высокой температуры в область низкой, причем только часть теплоты может быть переведена в механическую работу.
 2014-02-02
2014-02-02 589
589








