Рабочие растворы ЭДТА с(1/1ЭДТА) = 0,01 – 0,05 моль/дм3.
Стандартные вещества либо растворы МgSO4, приготовленные из фиксанала, или металлический цинк растворенный в хлороводородной кислоте.
1) Определение общей жесткости воды, моль/дм3(мг-экв/дм3) – суммарное содержание солей Са и Мg, титрование проводят в присутствии аммонийной буферной смеси.
Q = 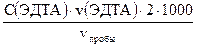
2) Определение Са2+ в присутствии Мg2+
Са2+ - определяется в щелочной среде при титровании с мурексидом; Мg2+ - по разности.
3) Определение ионов Ме в смеси без предварительного разделения.
Изменяя рН можно определить один ион в присутствии других.
при рН 1 – 2 – определяют Fe3+
рН = 5 – определяю. Аl3+
рН ≥ 9,2 – определяют Са2+, Мg2+.
4) Определение анионов – например РО43- осаждают избытком Мg2+, избыток оттитровывают ЭДТА (титрование по остатку).
 2014-02-02
2014-02-02 616
616








