Иностранные специалисты прилагают активные усилия к уменьшению электрического поля корабля различными путями:
· путем постройки корпуса корабля из однородных материалов;
· тщательной окраской корпуса;
· изолированием друг от друга больших поверхностей.
Мероприятия по снижению величины электрического поля корабля во многом совпадают с мероприятиями по уменьшению электрохимической коррозии. Защита металлов от электрохимической коррозии может осуществляться различными методами.
1. Электрохимической защитой металлов.
2. Использованием покрытий.
3. Химической и электрохимической обработкой поверхности защищаемого металла.
Кратко познакомимся с ними.
1. Электрохимическая защита металлов от коррозии осуществляется путем их катодной или анодной поляризации.
Катодная защита осуществляется присоединением защищаемой металлической конструкции либо к отрицательному полюсу внешнего источника постоянного тока (т.е. в качестве катода), либо к металлу, имеющему более отрицательный потенциал. Первый из этих способов (подача постоянного тока от внешнего источника) получил название катодной защиты, а второй – протекторной защиты.
|
|
|
Смысл защиты путем анодной поляризации заключается в том, что защищаемый металл присоединяют к положительному полюсу внешнего источника постоянного тока или контактируют с металлом, имеющим более положительный потенциал. Защищаемая конструкция при анодной защите становится анодом, при этом уменьшение скорости коррозии наступает при условии перевода ее в пассивное состояние.
Наиболее широкое применение для борьбы с морской коррозией металлов нашла катодная защита. Применением катодной поляризации можно достичь торможения или полного прекращения работы микроэлементов системы, вследствие превращения поверхности защищаемого металла в катодную. Катодная защита внешним током, осуществляемая подачей постоянного тока от внешнего источника, к отрицательному полюсу которого (т.е. в качестве катода) присоединяется защищаемая конструкция, а к положительному полюсу (т.е. в качестве анода) присоединяется дополнительный электрод, схематично показана на рис. 16.
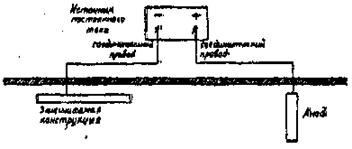 Рис. 16. Катодная защита внешним током.
Рис. 16. Катодная защита внешним током.
|
Конструкция будет защищена от коррозии, так как в процессе работы разрушается (растворяется) анод, а катод не разрушается.
Для катодной защиты обязательным является наличие вокруг защищаемой конструкции электролита. Расположение анодов должно обеспечивать ток равномерной плотности на поверхности защищаемой конструкции. Величина оптимальной защитной плотности тока зависит от природы защищаемого металла, действующей на металл коррозионной среды, явлений поляризации и переходного сопротивления между металлом и средой. Практически полная защита в 97-98% случаев достигается при значениях плотности тока около 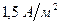 . Для углеродистой стали в среде 3-процентного раствора
. Для углеродистой стали в среде 3-процентного раствора  защитная плотность тока составляет
защитная плотность тока составляет 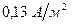 при напряжении
при напряжении 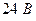 . Для защиты конденсатора мощностью
. Для защиты конденсатора мощностью 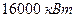 со стальными трубными досками и латунными трубками использовался ток силой
со стальными трубными досками и латунными трубками использовался ток силой 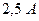 при напряжении
при напряжении 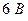 .
.
|
|
|
Превышение оптимальной защитной плотности тока снижает защиту. Такое явление называется перезащитой.
2. Для защиты изделий от электрохимической коррозии применяются также различные металлические и неметаллические покрытия. Покрытие изолирует металл от действия среды и устраняет работу микроэлементов на поверхности металлов,
Металлические покрытия наносятся на защищаемую металлическую поверхность различными методами: гальваническим, диффузионным, распадением (металлизацией), погружением в расплавленный металл (горячим методом), механо-термическим (плакированием). По механизму защиты эти покрытия разделяются на анодные и катодные. Металл анодных покрытий имеет электродный потенциал более отрицательный, чем потенциал защищаемого металла. При повреждении анодного покрытия, в условиях воздействия растворов электролитов, возникает коррозионный элемент металл-покрытие, в котором защищаемый металл не разрушается (так как является катодом), а покрытие, являющееся анодом – растворяется. Пример такого процесса приведен на рис. 17.
При повреждении защитного слоя в возникающей гальванической паре сталь служит катодом, а цинк – анодом (электроны переходят от цинка к стали). Поэтому цинк разрушается, а сталь сохраняется защищенной.
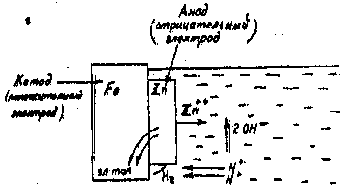 Рис. 17. Механизм электрохимической коррозии при повреждении анодного покрытия
Рис. 17. Механизм электрохимической коррозии при повреждении анодного покрытия
|
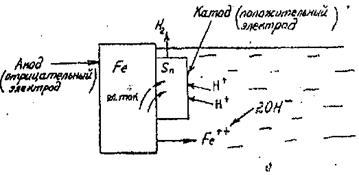 Рис. 18. Механизм электрохимической коррозии при повреждении катодного покрытия.
Рис. 18. Механизм электрохимической коррозии при повреждении катодного покрытия.
|
Металл катодных покрытий стоит в ряду напряжений правее защищаемого (имеет электродный потенциал более положительный, чем потенциал защищаемого металла). Это покрытие может быть надежной защитой от коррозии при отсутствии в нем пор, трещин и других дефектов. Примером катодных покрытий может служить луженая, т.е. покрытая оловом, сталь. При нарушении целостности полуды и соприкосновении стали с водой, образуется гальваническая пара, в которой положительным электродом (катодом) служит олово, а отрицательным (анодом) – сталь (рис. 18).
Из рисунка видно; поток электронов направляется от обнаженной стали к олову при этом сталь подвергается разрушению, посылая ионы железа в раствор.
Материал неметаллических покрытий существенно отличается от металлических малой или совершенно отсутствующей электропроводностью. В связи с этим, характер коррозии этих материалов отличается от характера коррозии металлов: их разрушение вызывается химическими или физико-механическими факторами, не электрохимическими процессами. Среди неметаллических покрытий в антикоррозийной технике широко распространены материалы и композиции на основе натурального и синтетического каучука. Защита металлических конструкций обкладками из резины (гуммирование) может выполняться различными методами: обкладкой металлической поверхности листами сырой резиновой смеси с последующей вулканизацией; нанесением покрытий в виде жидкостей или паст с последующей горячей или холодной вулканизацией и др. Однако не все металлы пригодны для применения этого вида защиты, Так, резина обладает хорошей адгезией (адгезия – способность одного вещества прочно удерживаться на поверхности другого) к стали, чугуну, олову, цинку, хрому. При гуммировании же свинца и алюминия процесс старения резины ускоряется. Медь для гуммирования непригодна (поэтому перед покрытием резиной ее лудят). Известны и другие неметаллические покрытия.
|
|
|
3. Химические и электромеханические методы обработки металлической поверхности связаны с получением на них коррозионно-стойких защитных пленок. К числу таких покрытий относятся:
· оксидирование – создание на поверхности металлов слоя окислов, обладающих большей коррозионной стойкостью, чем основной металл;
· фосфатирование – процесс получения на поверхность стали (или цветных металлов таких, как цинк, магний и др.) пленки фосфорнокислой соли железа и марганца;
· анодирование;
· химическое никелирование.
Уменьшение интенсивности электрохимической коррозии может быть достигнуто и использованием некоторых веществ ингибиторов, на которых мы останавливаться не будем.
 2014-02-02
2014-02-02 1596
1596








