Реакция окисления горючих веществ при определенных условиях может самопроизвольно ускоряться и переходить в реакцию горения. Такой процесс возникновения горения называется самовоспламенением. Самовоспламенение может быть тепловое и цепное. При тепловом самовоспламенении причиной ускорения реакции окисления и возникновения горения является превышение скорости выделения тепла над скоростью теплоотвода, а при цепном — превышение вероятности разветвлений цепей над вероятностью их обрывов. Обычно горение возникает в результате теплового самовоспламенения, хотя само химическое превращение при этом может протекать в виде цепных реакций.
Представление о том, что ускорение реакции в газовой смеси обусловлено преобладанием скорости тепловыделения над скоростью теплоотвода, высказывал еще знаменитый голландский химик Я. Г. Вант-Гофф. Однако только в 1928 г. академик Н. Н. Семенов разработал детальную количественную теорию теплового самовоспламенения.
Рассмотрим эту теорию на примере самовоспламенения смеси горючих газов с воздухом, находящейся в сосуде объемом V. При низкой температуре смеси Тн реакция между горючим газом и кислородом воздуха практически не протекает. Чтобы она началась, нужно смесь нагреть до более высокой температуры. Если сосуд и смесь в нем нагреть до температуры Т0, значительно превышающей Тн, начнется химическая реакция окисления с выделением тепла. Скорость выделения тепла q1 (в кДж/с) в сосуде определяется значением теплоты горения газа, объемом смеси и скоростью реакции окисления
|
|
|
q1 = QV v
гдеQ— теплота горения газа, кДж/моль; V — объем горючей сме-
си, мэ; v —скорость реакции, моль/(м3с).
Подставляя выражение скорости реакции, получим
q1 = QV k С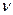 е-Е/RT (16)
е-Е/RT (16)
где k — константа скорости реакции; 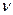 — порядок реакции; -е!Rт — экспоненциальная функция Аррениуса, выражающая зависимость скорости реакции от температуры.
— порядок реакции; -е!Rт — экспоненциальная функция Аррениуса, выражающая зависимость скорости реакции от температуры.
Количество отводимого тепла q2 в единицу времени в первом приближении можно считать пропорциональным разности температур смеси и окружающей среды
q2 =  S (Т – То ) (17)
S (Т – То ) (17)
где  — коэффициент теплоотдачи от газа стенке сосуда,
— коэффициент теплоотдачи от газа стенке сосуда,
кДж/(м2сК); S — поверхность стенок сосуда, м2; Т —температура смеси, К; Т0 — температура стенок сосуда, К.
Н. Н. Семенов первым показал, что в химических системах, в которых возможна разветвленная цепная реакция, самоускорение реакции, приводящее к самовоспламенению, может произойти при постоянной температуре. Такое самовоспламенение было названо цепным. Условием цепного самовоспламенения является превышение в системах числа разветвляющихся цепей над числом обрывающихся цепей.
|
|
|
Чисто цепное самовоспламенение — довольно редкое явление, так как оно протекает при таких низких давлениях и температурах, при которых немногие горючие вещества самовоспламеняются. (Самовоспламенение смеси водорода с кислородом при 485°С происходит в интервале давлений от 773 до 1093 Па.
 2014-02-02
2014-02-02 3424
3424








