Для аквакомплексов в водном растворе общие константы устойчивости условно приняты равными нулю.
Сравнение устойчивости комплекса [MLn] при n = соnst для различных M или L проводится по значениям константы βn(уст.)
При рассмотрении процесса диссоциации комплексного иона согласно закону действия масс, состояние равновесия можно выразить с помощью константы диссоциации. Поскольку диссоциация внутренней координационной сферы идет лишь в незначительной степени, она может быть охарактеризована константой нестойкости или константой распада комплекса (К нест. ).
Пример: Написать процессы диссоциации хлорида диаммин серебра.
Решение:
1) В хлориде диаммин серебра первичная диссоциация проходит как у любой соли на катион и анион:
[Ag (NH3)2]Cl «[Ag (NH3)2]+ + Cl -;
2) Затем комплексный ион по стадиям диссоциирует на составные части:
1 ступень - [Ag (NH3)2]+ «[Ag (NH3)]+ + NH3;
2 ступень - [Ag(NH3)]+ «Ag+ + NH3.
3) Тогда для каждой ступени константа нестойкости (К нест. ):
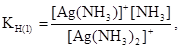
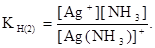
4) Суммарно этот процесс записывают так:
[Ag(NH3)]+ «Ag+ + 2 NH3, 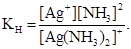
Чем больше константа нестойкости, тем сильнее комплекс диссоциирует и тем менее он устойчив.
Взаимосвязь между константой образования комплексаи константой нестойкости можно выразить следующим выражением:
βn(уст.) = 1 / К нест. (5.2)
Пример: Написать уравнения диссоциации комплексных соединений:
а) K3[Al(OH)6]; б) [Pt(NH3)4]Cl2; в) [Co(H2O)4Cl2].
Решение:
1) Для а) K3[Al(OH)6]:
1 ступень: K3[Al(OH)6] «3K+ + [Al(OH)6]3-;
2 ступень: [Al(OH)6]3- «Al3+ + 6OH -;
2) Для б) [Pt(NH3)4]Cl2:
1 ступень: [Pt(NH3)4]Cl2 «[Pt(NH3)4]2+ + 2Cl -;
2 ступень: [Pt(NH3)4] «Pt2+ + 4NH3;
3) Для в) [Co(H2O)4Cl2]:
1 ступень: [Co(H2O)4Cl2] «Co2+ + 4H2O + 2Cl -.
 2014-02-02
2014-02-02 933
933







