До сих пор мы рассматривали зависимость скорости от констант реагентов, однако очевидно, что большое влияние на скорость реакции оказывает изменение температуры.
Вант-Гоффу принадлежит утверждение, что скорость химической реакции (u) при увеличении температуры на 10°С увеличивается в 2-4 раза.
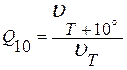 .
.
Позднее установили, что для:
химической реакции Q10=2-4,
физической реакции Q10=1,1-1,2,
ферментативной реакции Q10~1,7.
Вант-Гофф установил, что константа равновесия К подчиняется уравнению:
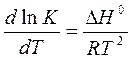 .
.
Аррениус подставил в это уравнение вместо К константу скорости k. Хотя этот переход строго математически не доказан, но на практике он всегда оказывается верен:
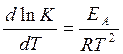 ., где:
., где:
ЕА – энергия активации реакции, то есть та энергия, которой молекулы должны обладать, чтобы преодолеть силы отталкивания.
Решая это уравнение, получим: LnK=LnA-EA/RT, где:
LnA- константа интегрирования,
Графически это уравнение, называют диаграмма Аррениуса, из которой легко определить ЕА реакции как тангенс угла α наклона (Рис. 1)
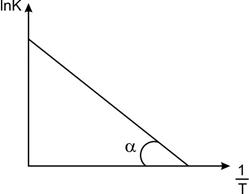
| Рис.1.Диаграмма Аррениуса По оси х – величина обратная температуре 1/Т; по оси у – LnK реакции |
Энергия активации реакции определяется так же с помощью Q10:
|
|
|
EA=0,46 T1 T2 lgQ10.
В уравнении Аррениуса:
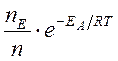 – множитель Больцмана, который отражает долю молекул, обладающих энергией Е ³ ЕА, где:
– множитель Больцмана, который отражает долю молекул, обладающих энергией Е ³ ЕА, где:
(nE) относительно всех молекул (n).
Тогда константа интегрирования A складывается из двух составляющих:
Z-вероятность столкновения молекул,
р-вероятность столкновения активными центрами – стерический коэффициент.
Для малых молекул он стремится к единице, а для макромолекул: <<1.
Таким образом, в окончательном виде уравнение Аррениуса:
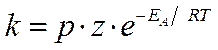 .
.
 2014-02-03
2014-02-03 622
622








