Фенилаланин – предшественник тирозина. Основной и, по-видимому, единственной функцией фенилаланина, не считая участия в синтезе белков и пептидов, является использование его в качестве источника
У семейств фумаровой кислоты и ацетил-КоА есть общие аминокислоты.
Самое большое из всех семейств аминокислот - это семейство ацетил-КоА. Это и не удивительно, поскольку ацетил-КоА один из важнейших промежуточных метаболитов клетки. Семейство пирувата (аланин, цистеин, цистин, глицин, серии и треонин), можно считать принадлежащим и к семейству ацетил-КоА (см обмен углеводов). 5 аминокислот (тирозин, фенилаланин лейцин, лизин и триптофан) образуют ацетоацетил-СоА, который легко превращается в ацетилКоА. Тирозин и фенилаланин одновременно можно рассматривать и как членов семейства фумарата. Изолейцин, лейцин и триптофан являются прямыми источниками ацетил-КоА
Основной и, по-видимому, единственной функцией фенилаланина, не считая участия в синтезе белков и пептидов, является использование его в качестве источника тирозина. 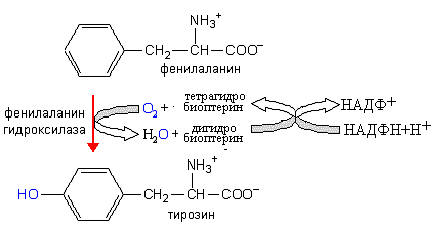
Эта реакция катализируется фенилаланингидроксилазой- ферментом, который обладает двумя каталитическими активностями: дигидробиоптеринредуктазной (восстановление дигидробиоптерина с участием НАДФН+Н+ в тетрагидробиоптерил) и гидроксилазной (восстановление О2 в воду и фенилаланина в тирозин). Фенилаланин может подвергаться переаминированию с a-кетоглутаровой кислотой с образованием фенилпирувата. катализируется фенилаланингидроксилазой- ферментом, который обладает двумя каталитическими активностями: дигидробиоптеринредуктазной (восстановление дигидробиоптерина с участием НАДФН+Н+ в тетрагидробиоптерил) и гидроксилазной (восстановление О2 в воду и фенилаланина в тирозин). Фенилаланин может подвергаться переаминированию с a-кетоглутаровой кислотой с образованием фенилпирувата. Фенилпировинофениллактата или подвергается окислительному
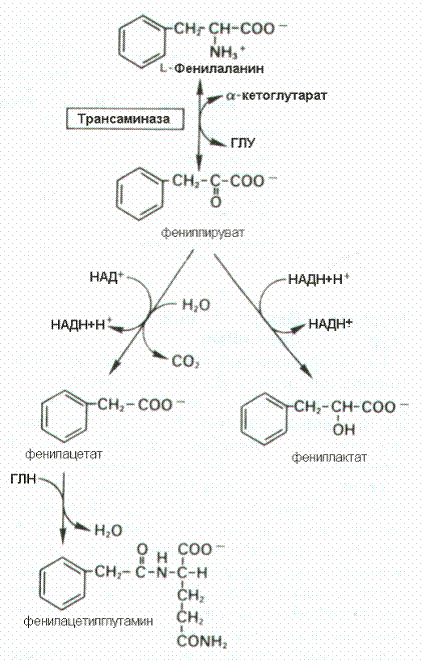
декарбоксилированию, продукт которого связываясь с глутамином в форме фенилацетилглутамина выделяется. Эти реакции протекает в печени у здоровых людей, однако количество катаболизируемого таким образом фенилаланина незначительно. Эти пути приобретают значимость при нарушении функции фенилаланингидроксилазырадная
декарбоксилированию, продукт которого связываясь с глутамином в форме фенилацетилглутамина выделяется. Эти реакции протекает в печени у здоровых людей, однако количество катаболизируемого таким образом фенилаланина незначительно. Эти пути приобретают значимость при нарушении функции фенилаланингидроксилазырадная кислота восстанавливается с образованием фениллактата или подвергаетсядекарбоксилированию, продукт которого связываясь с глутамином в форме фенилацетилглутамина выделяется. х людей, однако количество катаболизируемого таким образом фенилаланина незначительно. Эти пути приобретают значимость при нарушении функции фенилаланингидроксилазы
 |
.
Нарушение функции фенилаланин гидроксилазы – причина фенилкетонурии
Учитывая указанные выше особенности функции фенилаланингидрокислазы, могут быть три основные причины нарушения превращения фенилаланина в тирозин
- недостаточность фенилаланингидроксилазной активности (гиперфенилаланинемия типа I, или классическая фенилкетонурия)
- недостаточность дигидробиоптеринредуктазной активности (гиперфенилаланинемия типов II и III)
- нарушение биосинтеза дигидробиоптерина (гиперфенилаланинемия типов IV и V).
Гнперфеннлаланинемия типа I (классическая фенилкетонурия, ФКУ) проявляется умственной отсталостью, припадками, психозами, экземой и появлением «мышиного» запаха. Указанные симптомы при раннем диагнозе и своевременном лечении могут не проявиться. Классическая ФКУ встречается с частотой 1 на 10000 новорожденных, активность фермента составляет до 25% от нормы и фермент утрачивает чувствительность к регуляторному действию фенилаланина.
Нарушение превращения в тирозин резко усиливает альтернативные пути превращения фенилаланина. В крови увеличивается уровень фенилаланина, растет его выделение почками, а в крови и моче появляются фенилпируват, фениллактат, фенилацетат и фенилацетилглутамин. Появление в крови и моче кетокислоты фенилпирувата определило и само название болезни—фенилкетонурия. Для выявления этого заболевания помимо открытия присутствия фенилпирувата в моче необходимо определить содержание фенилаланина в плазме крови. Ранняя диагностика и назначение диеты с очень низким содержанием фенилаланина позволяет предотвратить все симптомы и неблагоприятные последствия этого заболевания. Эту диету следует использовать до достижения шестилетнего возраста, когда снижается неблагоприятное влияние на развитие мозга промежуточных метаболитов фенилаланина.
Фенилаланин может подвергаться переаминированию с a-кетоглутаровой кислотой с образованием фенилпирувата. Фенилпировинорадная кислота восстанавливается с образованием фениллактата или подвергается окислительному декарбоксилированию, продукт которого связываясь с глутамином в форме фенилацетилглутамина выделяется. Эти реакции протекает в печени у здоровых людей, однако количество катаболизируемого таким образом фенилаланина незначительно. Эти пути приобретают значимость при нарушении функции фенилаланингидроксилазы
 |
.
Нарушение функции фенилаланин гидроксилазы – причина фенилкетонурии
Учитывая указанные выше особенности функции фенилаланингидрокислазы, могут быть три основные причины нарушения превращения фенилаланина в тирозин
катаболизируемого таким образом фенилаланина незначительно. Эти пути приобретают значимость при нарушении функции фенилаланингидроксилазы
 |
.
Нарушение функции фенилаланин гидроксилазы – причина фенилкетонурии
Учитывая указанные выше особенности функции фенилаланингидрокислазы, могут быть три основные причины нарушения превращения фенилаланина в тирозин
- недостаточность фенилаланингидроксилазной активности (гиперфенилаланинемия типа I, или классическая фенилкетонурия)
- недостаточность дигидробиоптеринредуктазной активности (гиперфенилаланинемия типов II и III)
- нарушение биосинтеза дигидробиоптерина (гиперфенилаланинемия типов IV и V).
Гнперфеннлаланинемия типа I (классическая фенилкетонурия, ФКУ) проявляется умственной отсталостью, припадками, психозами, экземой и появлением «мышиного» запаха. Указанные симптомы при раннем диагнозе и своевременном лечении могут не проявиться. Классическая ФКУ встречается с частотой 1 на 10000 новорожденных, активность фермента составляет до 25% от нормы и фермент утрачивает чувствительность к регуляторному действию фенилаланина.
Нарушение превращения в тирозин резко усиливает альтернативные пути превращения фенилаланина. В крови увеличивается уровень фенилаланина, растет его выделение почками, а в крови и моче появляются фенилпируват, фениллактат, фенилацетат и фенилацетилглутамин. Появление в крови и моче кетокислоты фенилпирувата определило и само название болезни—фенилкетонурия. Для выявления этого заболевания помимо открытия присутствия фенилпирувата в моче необходимо определить содержание фенилаланина в плазме крови. Ранняя диагностика и назначение диеты с очень низким содержанием фенилаланина позволяет предотвратить все симптомы и неблагоприятные последствия этого заболевания. Эту диету следует использовать до достижения шестилетнего возраста, когда снижается неблагоприятное влияние на развитие мозга промежуточных метаболитов фенилаланина.
При изучении основных путей катаболизма тирозина важную роль сыграли исследования генетических заболеваний. Первая реакция катаболизма тирозина подобна таковой для фенилаланина – трансаминирование с образованием парагидроксифенил-пирувата, которое катализируется тирозин-a-кетоглутарат-трансаминазой в печени млекопитающих.

Превращение в гомогентизиновую кислоту происходит при участии пара гидроксифенилпируват гидроксилазы. Этот медь содержащий фермент катализирует сложную реакцию, сопровождающуюся переносом боковой цепи, декарбоксилированием и гидроксилированием кольца. Кофактором этой реакции, по-видимому, служит аскорбиновая кислота, поскольку больные цингой выделяют мочой промежуточные продукты метаболизма тирозина. Раскрытие кольца гомогентизиновой кислоты происходит под влиянием оксидазы гомогентизиновой кислоты.— железосодержащего металлопротеина печени млекопитающих. Образующийся малеилацетоацетат превращается в свой изомер фумарилацетоацетат при участии цис, трансизомеразы и гидролаза фумарилацетоацетата завершает катаболический путь тирозина образованием фумарата и ацетоацетата, последний может превратиться в ацетил-КоА.
 2014-02-03
2014-02-03 2193
2193








