4. Кислоты
Кислотами называют сложные вещества, способные диссоциировать с образованием катионов водорода и анионов кислотных остатков:
H2SO4 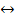 2H+ +SO42- (14)
2H+ +SO42- (14)
Среди кислот есть сильные (например, HCl, HI, H2SO4, HNO3) и слабые (например, H2SO3, H2S, H3PO4, H2CO3, CH3COOH, H2SiO3). (Приложение 4 – Степени диссоциации электролитов).
Таблица 2.
| кислота | кислотный остаток | ||
| HCl | соляная | Cl- | хлорид |
| HI | иодоводородная | I- | иодид |
| H2SO4 | серная | SO42- | сульфат |
| H2SO3 | сернистая | SO32- | сульфит |
| H2S | сероводородная | S2- | сульфид |
| HNO3 | азотная | NO3- | нитрат |
| H3PO4 | фосфорная | PO43- | фосфат |
| H2CO3 | угольная | CO32- | карбонат |
| CH3COOH | уксусная | CH3COO- | ацетат |
| H2SiO3 | кремниевая | SiO32- | силикат |
4.1. Общие способы получения кислот
1) Растворимые в воде кислоты можно получить из их ангидридов (соответствующих кислотных оксидов):
SO3 + H2O  H2SO4 (15)
H2SO4 (15)
|
|
|
2) Бескислородные кислоты можно получить непосредственным взаимодействием неметалла с водородом:
H2 + Cl2  2HCl (16)
2HCl (16)
3) Слабые или нерастворимые в воде кислоты можно получить из их солей:
Na2SiO3 + 2HCl  H2SiO3 + 2NaCl (17)
H2SiO3 + 2NaCl (17)
4.2. Общие свойства кислот
1) Взаимодействие c металлами:
Fe + H2SO4  FeSO4 + H2 (18)
FeSO4 + H2 (18)
2) Взаимодействие с основными и амфотерными оксидами:
FeO + H2SO4  FeSO4 + H2O (19)
FeSO4 + H2O (19)
3) Взаимодействие с основаниями:
Fe(OH)2 + H2SO4  FeSO4 + 2H2O (20)
FeSO4 + 2H2O (20)
4) Кислоты могут взаимодействовать с солями:
Na2СO3 + 2HCl  2NaCl + CO2 + H2O (21)
2NaCl + CO2 + H2O (21)
5. Основания
Основаниями называются сложные вещества, способные диссоциировать с образованием катионов металла и гидроксид-анионов (OH-):
NaOH 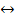 Na+ + OH- (22)
Na+ + OH- (22)
Среди оснований есть сильные и слабые электролиты (Приложение 4). Сильные хорошо растворимые в воде основания называются щелочами (NaOH, KOH, Ba(OH)2).
|
|
|
При взаимодействии с водой аммиак образует катион аммония NH4+ и гидроксид-анион:
NH3 + H2O 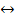 NH4+ + OH- (23)
NH4+ + OH- (23)
Таким образом, аммиак проявляет основные свойства.
5.1. Общие способы получения оснований
1) Щелочи можно получить при взаимодействии металла с водой:
2Na + 2H2O  2NaOH + H2 (24)
2NaOH + H2 (24)
2) Щелочи можно получить взаимодействием оксидов с водой:
Na2O + H2O  2NaOH (25)
2NaOH (25)
3) Щелочи можно получить электролизом, то есть химическим взаимодействием, протекающим под действием электрического тока:
2NaCl + 2H2O  H2 + Cl2 + 2NaOH (26)
H2 + Cl2 + 2NaOH (26)
4) Слабые или нерастворимые в воде основания можно получить из их солей:
CuSO4 + 2NaOH  Cu(OH)2 + Na2SO4 (27)
Cu(OH)2 + Na2SO4 (27)
5.2. Общие свойства оснований
1) Взаимодействие с кислотами:
2NaOH + H2SO4  Na2SO4 + 2H2O (28)
Na2SO4 + 2H2O (28)
2) Взаимодействие с кислотными оксидами:
2NaOH + SO3  Na2SO4 + H2O (29)
Na2SO4 + H2O (29)
3) Основания могут взаимодействовать с солями:
2NaOH + MgCl2  Mg(OH)2 + 2NaCl (30)
Mg(OH)2 + 2NaCl (30)
4) При взаимодействии аммиака с кислотами образуются соли аммония:
3NH3 + H3PO4  (NH4)3PO4 (31)
(NH4)3PO4 (31)
5) Нерастворимые в воде основания способы термически разлагаться:
Cu(OH)2  CuO + H2O (32)
CuO + H2O (32)
6. Соли
Солями называются сложные вещества, способные диссоциировать на катионы металлов и анионы кислотных остатков (12). Практически все соли являются сильными электролитами.
Для написания формул солей следует выучить таблицы 1 и 2, в которых даны заряды катионов и анионов. Если требуется составить формулу сульфата алюминия, необходимо найти наименьшее общее кратное между степенями окисления алюминия (+3) и зарядом сульфата (2-), взятыми по модулю. Наименьшим общим кратным чисел 3 и 2 является 6. Если наименьшее общее кратное 6 разделить на 3, получится число атомов алюминия в молекуле (2), если наименьшее общее кратное 6 разделить на 2, получится число сульфат-анионов в молекуле сульфата алюминия. Соответствующая формула Al2(SO4)3 означает, что в одной молекуле содержится 2 атома алюминия и три сульфат-аниона.
6.1. Общие способы получения солей
1) Взаимодействие металла и неметалла:
Cu + Cl2  CuCl2 (33)
CuCl2 (33)
2Fe + 3Cl2  2FeCl3 (34)
2FeCl3 (34)
2) Взаимодействие металла с кислотой:
Fe + 2HCl  FeCl2 + H2 (35)
FeCl2 + H2 (35)
3) Атомы металлов, расположенных в ряду напряжений (Приложение 5) выше, способны вытеснять катионы металлов, расположенных в ряду напряжений ниже, из растворов (взаимодействие металлов с солями):
|
|
|
Fe + CuSO4  Cu + FeSO4 (36)
Cu + FeSO4 (36)
4) Взаимодействие оксидов основных с оксидами кислотными:
CaO + CO2  CaCO3 (37)
CaCO3 (37)
CuO + SO3  CuSO4 (38)
CuSO4 (38)
5) Взаимодействие оксидов основных с кислотами:
CuO + H2SO4  CuSO4 + H2O (39)
CuSO4 + H2O (39)
6) Взаимодействие оксидов кислотных с оксидами основаниями:
Ca(OH)2 + CO2  CaCO3 + H2O (40)
CaCO3 + H2O (40)
7) Взаимодействие кислот и оснований (реакция нейтрализации):
H2SO4 + 2KOH  K2SO4 +2H2O (41)
K2SO4 +2H2O (41)
6.2. Общие свойства солей
1) Взаимодействие с основаниями:
FeCl3 + 3NaOH  FeCl3 + 3H2O (42)
FeCl3 + 3H2O (42)
2) Взаимодействие с кислотами:
Na2SiO3 + 2HCl  H2SiO3 + 2NaCl (43)
H2SiO3 + 2NaCl (43)
3) Взаимодействие двух солей:
AgNO3 + NaCl  AgCl + NaNO3 (44)
AgCl + NaNO3 (44)
4) Термическое разложение:
СaCO3  CaO + CO2 (45)
CaO + CO2 (45)
CuSO4  CuO + SO3 (46)
CuO + SO3 (46)
5) Взаимодействие с металлом рассмотрен ранее (36).
Задания для самостоятельной работы:
1)Напишите для каждого класса веществ (металлы, неметаллы, оксиды, кислоты, основания, соли) по пять формул, а также названия веществ.
|
|
|
2) Напишите уравнения реакция взаимодействия соляной кислоты с металлами: натрием, цинком, алюминием.
3) Напишите уравнения реакций получения сульфата меди (+2) максимально возможным количеством способов.
4) Напишите уравнения реакций получения карбоната кальция максимально возможным количеством способов.

Приложение 1 – таблица химических элементов Д.И. Менделеева
Приложение 2 - список русских и латинских названий элементов
 |
 |
 |
 |
Приложение 3 – таблица растворимости

Приложение 4 – Примеры степеней диссоциации некоторых электролитов

Приложение 5 Ряд стандартных окислительно-восстановительных электродных
потенциалов металлов (ряд «напряжений»).
 |
 2021-12-25
2021-12-25 227
227







