Таблица 3 - Биохимические признаки и другие свойства
Лецитиназа.Фермент бактерий, расщепляющий лецитин, выявляют путем посева культуры стафилококков на желточный агар. Готовят желточный агар: пептон — 20 г, гидрофосфат натрия — 2,5 г, натрий — 1 г, 0,5%-й раствор сульфата магния — 0,1 мл, глюкоза — 1 г, агар — 12,5 г, вода дистиллированная — 500 мл. Устанавливают рН 7,2-7,4, стерилизуют при 121°С 15 мин, охлаждают до 55 °С, добавляют один стерильный желток на 500 мл среды, компоненты перемешивают и смесь разливают в чашки Петри. Исследуемую культуру засевают дробно на желточный агар, культивируют при 37-38 °С 24-48 ч. Положительный результат — появление зоны помутнения вокруг колоний.
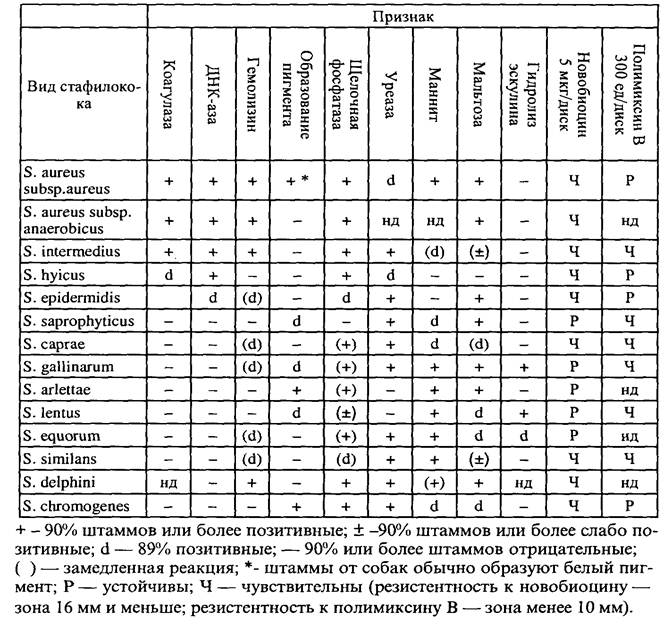
Таблица 2 - Свойства основных патогенных видов стафилококков
Грамположительных кокков
Таблица 1 - Дифференциация стафилококков от других
| Признаки | Стафилококки | Микрококки | Энтерококки | Стрептококки |
| Ферментация глюкозы (ОФ-тест) | + | - | + | + |
| Каталаза | + | + | - | - |
| Оксидаза | - | + | - | - |
| Коагулаза | + | - | - | - |
| Чувствительность к бацитрацину (0,04 ЕД/диск) | - | + | - | - |
Определение патогенных свойств стафилококков, идентификация на уровне вида. Достаточно подробное изучение патогенных свойств стафилококка позволяет отнести выделенную культуру к одному из трех основных патогенных видов (табл.2). Исследование дополнительных ферментативных, культуральных и прочих свойств дает возможность идентифицировать другие виды стафилококков, достаточно часто выделяемые от животных (табл. 3). О присутствии патогенных свойств у выделенных культур судят, кроме того, по результатам биопроб, позволяющих, в том числе, доказать наличие энтеротоксина. Определение факторов патогенности проводят следующими методами.
|
|
|
Коагулаза. Фермент, вызывающий свертывание плазмы, на фибриноген непосредственно не действует. Для этой цели наиболее подходит цитрированная плазма кролика (1 объем 4%-ного раствора натрия цитрата + 9 объемов крови). При исследовании штаммов, выделенных от определенных видов животных, может быть использована их кровь (свиньи, КРС, собаки).
Цитратную кровь центрифугируют при 3000 об/мин в течение 10 минут, плазму отсасывают в стерильные пробирки, закрывают пробками, хранят до 3 недель при 4-5° С. При постановке опыта плазму разводят стерильным физиологическим раствором 1:5 и разливают по 0,5 мл в стерильные пробирки. Испытуемую культуру выращивают на МПА или МПБ 18-24 часа и вносят две капли бульонной или одну петлю агаровой культуры в пробирки с подготовленной плазмой. Параллельно проводят контроль плазмы без культуры бактерий. Пробирки ставят в термостат (37-38° С). Учет проводят через каждый час в течение 5-6 часов, при комнатной температуре 18 часов. Положительный результат — образование сгустка, который при наклоне пробирки удерживается. Стафилококки с выраженной патогенностью свертывают плазму в сроки до 2 часов. Наличие коагулазы наиболее четко коррелирует с патогенностью стафилококка.
|
|
|
| Признаки | S. aureus * | S. intermedius | S. hyicus |
| Коагулаза (плазма кролика) | + | d | D |
| Гемолизин (эритроциты КРС) | + | - | - |
| Гиалуронидаза | + | - | + |
| Лецитиназа | + | Н.Д. | Варьирующий признак (чаще +) |
| Протеин «А» | + | Варьирующий признак | + |
| ДНК-аза | + | + | + |
| Ферментация маннита аэробно анаэробно | + + | + - | - - |
| Мальтоза | + | (±) | - |
| Образование пигмента | + | - | - |
* — Анаэробный подвид S. aureus (S. subsp. anaerobicis) образует коагулазу, ДНК-азу, гемолизин, ферментирует мальтозу, не синтезирует пигмент (±) — 90% или более штаммов слабо позитивные d — 11-89% штаммов позитивные.
Фактор скучивания (Сhumping factог-СF). СF -фактор в отличие от коагулазы действует на фибриноген, что приводит к агрегированию стафилококков. Для выявления СF -фактора на предметном стекле в капле неразведенной цитратной плазмы суспендируют бактериальную массу стафилококков из агаровой культуры при помощи бактериологической петли. В положительных случаях агрегирование наступает в течение 1-2минут. Контролем служит взвесь стафилококков в физиологическом растворе. Результаты СF -теста хорошо коррелируют с результатами пробирочной пробы на коагулазу.
Фибринолизин (стрептокиназа). Исследуемую культуру микроорганизма засевают в виде «бляшки» на агар с 12 % цитрированной плазмы. Посевы инкубируют при 37 °С 23-24 ч. Положительный результат — появление зоны просветления вокруг колонии.
Протеин «А». Белковое вещество, которое часто обнаруживают на поверхности клетки S. aureus и S. hyicus, обладает способностью неспецифически связывать Fс-фрагменты молекул JgG. Обнаружение протеина «А» у стафилококков проводят следующим образом. Отмытые центрифугированием эритроциты барана суспензируют в физиологическом растворе, смешивают с гемолизином, разведенным физиологическим раствором. Компоненты выдерживают при 37°С. Эритроциты отмывают ценрифугированием и ресуспендируют в исходном объеме фгоиологического раствора. Каплю суспензии сенсибилизированных эритроцитов смешивают с бактериальной массой стафилококков при помощи бактериологической петли на предметном стекле. За счет протеина «А» стафилококков происходит агглютинация эритроцитов, содержащих на своей поверхности JgG (гемолизин).
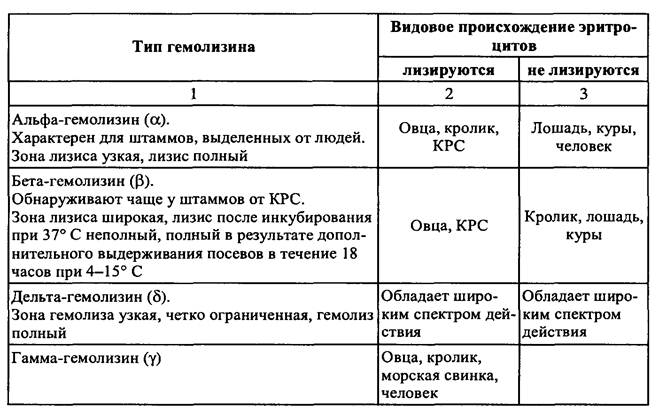
Гемолизины. Гемолитическую активность исследуют посевом на кровяной агар. Гемолизины стафилококков отличаются биохимическими, антигенными свойствами и литической активностью по отношению к эритроцитам различных видов животных. Известны четыре типа гемолизинов стафилококков (табл. 4).
Конкретный штамм стафилококков может синтезировать один тип гемолизина или несколько в различных комбинациях. При тестировании гемолитической активности у штаммов, особенно от КРС, необходимо учитывать наличие β-гемолизина и целесообразность дополнительного выдерживания посевов после инкубирования также при 4-15° С.
S. aureus, S. intermedius могут синтезировать одновременно α- и β -гемолизин, что приводит к образованию двойной зоны гемолиза: вблизи колонии — типа α, далее — β.
Таблица 4 -Спектр активности гемолизинов стафилококков
Гиалуронидаза (фактор проникновения). Обнаружение этого фермента у стафилококков практически наиболее легко осуществимо в тесте декапсуляции. Берут штаммы капсулообразующих видов бактерий, имеющих в составе капсулы гиалуроновую кислоту (субстрат для гиалуронидазы): Str. equi, Раsterella multocida (серовар А). На кровяной МПА в чашке Петри крестообразно засевают штрихом Str. equi или Р. multocida (тип А) и под углом 90° аналогично в виде линии культуру испытуемого стафилококка. Посевы инкубируют при 37° С в течение 24 часов. При наличии гиалуронидазы колонии тест-микроба вблизи штриха стафилококков образуются более мелкие и тусклые за счет разрушения капсулы ферментом, который диффундирует в толщу агара (результат положительный).
|
|
|
ДНК-аза. Нуклеаза обычно выявляется у S. aureus, S. intermedius,
S. hyicus. Исследуемую культуру бактерий засевают на питательный агар с ДНК и культивируют при 37 °С 24 ч. Затем на поверхность среды с бактериальной культурой наливают 1 н. раствор соляной кислоты. Положительный результат — при гидролизе ДНК вокруг выросшей культуры видна светлая зона.
Биопроба. Проводят для выявления патогенных свойств штаммов по летальному эффекту (биопроба на цыплятах), положительной дермонекротической реакции (некротоксин), а также на котятах для обнаружения способности продуцировать энтеротоксин. Известно шесть антигенноразличных энтеротоксинов (А, В, С, D, Е, F).
Дермонекротическая проба. У кролика-альбиноса массой 2-2,5 кг за сутки до опыта на боку выстригают два участка размером 2x2 см. 24-часовую бульонную испытуемую культуру вводят внутрикожно в дозе 0,2 мл на обоих участках. Положительный результат: через 24 часа на месте инъекции появляется гиперемия кожи, через 48 часов - некроз. Наблюдение продолжают 4 суток.
Биопроба на цыплятах. Проводят при изучении штаммов, выделенных от птиц. Суточную бульонную культуру в объеме 0,1 мл вводят во внешний угол глазницы двум 1-2-дневным цыплятам. Наблюдение ведут в течение 5 суток. Положительный результат: гибель цыплят на 3-5 сутки при выделении культуры стафилококков из паренхиматозных органов и костного мозга цыплят.
Обнаружение энтеротоксина в биопробе на котятах. Испытуемую культуру стафилококка засевают на среду для получения стафилококкового энтеротоксина. Культуру стафилококка выращивают на специальной питательной среде (пептон, хлорид кальция, хлорид магния, дигидрофосфат калия, 0,8 % агар-агара, рН 7,2), в атмосфере, содержащей 20 % оксида углерода в течение трех суток. Посевы инкубируют в эксикаторе с 20% СО2, что достигается смешением на дне сосуда (емк. 2000 мл) 2 г двууглекислой соды с 17 мл 10%-ный серной кислоты, после чего крышку эксикатора сразу закрывают. Посевы инкубируют при 37° С 3 суток, ежедневно дополняя вышеописанным способом СО2 в эксикаторе. На 4 сутки содержимое колбы фильтруют через мембранные фильтры № 3 или № 4. Приблизительно 10-15 мл фильтрата смешивают в равной пропорции с теплым молоком и скармливают 4-8-недельным котятам. Положительный результат: через несколько минут котята проявляют беспокойство, через 1-3 часа появляются симптомы гастроэнтерита: понос, рвота. Возможен летальный исход.
|
|
|
В специализированных лабораториях, при наличии соответствующих реактивов, энтеротоксин выявляют серологическими методами. Испытуемый штамм выращивают на подходящей среде, например сердечно-мозговом бульоне, и супернатант исследуют.
Серологически энтеротоксин обнаруживают в РДП или при помощи иммуноферментного метода. Возможно обнаружение токсинообразования следующим способом. К расплавленному и остуженному до 45°С МПА добавляют антитоксическую стафилококковую сыворотку
(S. аureus) до содержания в 1 мл среды 14-15 АЕ. Агар разливают по чашкам Петри и засевают дробно изучаемую культуру для получения изолированных колоний. Посевы инкубируют при 37° С 24-48 часов. Вокруг колоний токсигенных стафилококков формируются кольца преципитации.
Фаготипирование стафилококков. Проводят для обнаружения источника возбудителя и установления эпизоотологических (эпидемических) связей. Фаготиповая принадлежность является маркером, позволяющим устанавливать идентичность штаммов, даже если другие характеристики подверглись изменениям. Для фаготипирования S. аureus существует международный набор фагов, включающий 21 фаготип, разделенный на 5 фагогрупп (I-V). Для типирования штаммов, выделенных от КРС, предложен свой набор фагов, состоящий из фаготипов 42 Д, 78, 102, 107, 117, 118, 119. Техника фаготипирования сводится к следующему. Исследуемую культуру выращивают на скошенном МПА при 37-38° С в течение 18-24 часов, пересевают в пробирку с 2,5 мл бульона Хоттингера, инкубируют при 37° С 3-4 часа, засевают газоном в чашки Петри на 1,25%-ной МПА (рН 7,2-7,4) с 0,4% глюкозы и 0,02% кальция хлорида. Засеянные чашки подсушивают 30-40 минут в термостате, расчерчивают дно чашки на необходимое количество квадратов и стандартной бактериологической петлей (d=2 мм) в каждый квадратик вносят тот или иной фаг в рабочем титре. Бактериологическую петлю после каждой манипуляции прожигают. Посевы инкубируют 5-6 часов при 37° С или 18-20 часов при 30° С. Штаммы, не лизированные набором фагов, проверяют повторно, используя более концентрированный фаг (х 100). Степень лизиса оценивают по следующей схеме: «+ + + +» — полный лизис; «+ + +» — наличие в зоне лизиса колоний стафилококка; «+ +» — в зоне капли фага обнаруживают более 50 колоний фага; «+» — от 20 до 50 колоний фага;
«-» — полное отсутствие лизиса.
Штаммы стафилококков чаще лизируются несколькими фагами. В зависимости от спектра фагочувствительности стафилококк относят к какой-либо одной фагогруппе, например I, II и т. д., или к смешанной группе (I и III и т.д.).
 2014-02-17
2014-02-17 4700
4700








