Из предыдущего раздела следует, что любая материальная система в заданном фазовом состоянии при сравнительно малом отклонении от равновесия вследствие изменения независимых переменных (температуры, давления, числа молей компонентов, в том числе вследствие химических превращений) или воздействия внешних силовых полей, сохраняет устойчивость к флуктуациям или внешним возмущениям и релаксирует в равновесное термодинамически стабильное состояние, соответствующее измененным параметрам, вследстаие эффекта Ле Шателье - протекания самопроизвольных процессов, уменьшающих внешнее воздействие. Если при достижении определенных независимых параметров (температуры, давления, состава) фазовое состояние системы становится термодинамически неравновесным, а равновесным является другое фазовое состояние, то ее переход в новое равновесное фазовое состояние является фазовым переходом, связанным с потерей устойчивости системы к внешним или внутренним (локальным, микроскопическим) возмущениям (флуктуациям). Теоретически этот переход соответствует определенной точке (температуре, давлению или составу системы), в которой зависимости термодинамических потенциалов обоих фазовых состояний от этих параметров пересекаются, т.ее. их разность равна нулю. Очевидно, что условия потери устойчивости однородной (гомогенной) фазы к флуктуациям должны быть противоположными условиям ее устойчивости к ним. Соответственно, наиболее общий критерий нестабильности гомогенной фазы, в противоположность предложенному Гиббсом общему критерию стабильности гомогенной фазы, можно сформулировать так: если энергетическое выражение фундаментального термодинамического уравнения в интегральной форме 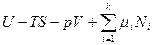 при определенных значениях интенсивных параметров Т, р,
при определенных значениях интенсивных параметров Т, р, 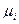 для какой-либо фазы не равно нулю, а для любой другой фазы, образованной из тех же компонентов, при тех же условиях будет равно нулю, то рассматриваемая фаза по отношению к распаду на другие фазы является термодинамически неустойчивой к флуктуациям или внешним возмущениям. В соответствие с энергетической теорией устойчивости Гиббса-Дюгема гомогенная система становится неустойчивой к флуктуациям, если их возникновение и рост становится энергетически выгодным (ΔфF <0 и ΔфG <0). При этом в случае гомогенных материальных систем возможны два варианта потери устойчивости и, соответственно, два типа фазовых переходов:
для какой-либо фазы не равно нулю, а для любой другой фазы, образованной из тех же компонентов, при тех же условиях будет равно нулю, то рассматриваемая фаза по отношению к распаду на другие фазы является термодинамически неустойчивой к флуктуациям или внешним возмущениям. В соответствие с энергетической теорией устойчивости Гиббса-Дюгема гомогенная система становится неустойчивой к флуктуациям, если их возникновение и рост становится энергетически выгодным (ΔфF <0 и ΔфG <0). При этом в случае гомогенных материальных систем возможны два варианта потери устойчивости и, соответственно, два типа фазовых переходов:
- при небольшом отклонении параметров состояния от их значений, соответствующих точке перехода, система может оставаться устойчивой к малым флуктуациям, что соответствует так называемому метастабильному состоянию, и быть неустойчивой к большим (сверхкритическим) флуктуациям объема (плотности) или состава (концентрации), переходя в новое фазовое состояние через образование и термодинамически выгодный устойчивый рост таких флуктуаций (зародышей новой фазы): ΔфF <0 и ΔфG <0 и претерпевать так называемый фазовый переход 1-го рода;
- при большом отклонении параметров состояния от их значений, соответствующих точке перехода и при условии, что фазовый переход 1-го рода невозможен из-за геометрических (стерических) или кинетических ограничений, могут достигаться условия термодинамически выгодного роста любых флуктуаций и происходить переход системы в новое состояние через рост любых флуктуаций, т.е. через непрерывное перерождение первоначальной состояния - критический фазовый распад, или непрерывный фазовый переход 2-го рода.
Фазовое равновесие и температурные фазовые переходы первого рода простых гомогенных материальных систем хорошо описываются классическими теориями конденсации паров в жидкое состояние, кристаллизации жидкостей и нуклеационного фазового разделения бинарных смесей ограниченно растворимых некристаллизующихся жидкостей при сравнительно небольшом их переохлаждении ниже равновесной (термодинамической) температуры перехода Tm, определяемой по соотношению изменений энтальпии и энтропии системы в равновесных слостояниях до и после перехода. При этом в современных подходах материальные системы подразделяются на два основных тип в зависимости от межатомных и межмолекулярных связей на «жесткие» (hard matter) и мягкие (soft matter) системы. К первому типу относятся металлы и неорганические неметаллические материалы (керамики, стекла – окидные, нитридные и др.) с металлическими, ионными, ковалентными и ионноковалентными межатомными связями), а ко второму – органические вещества, в том числе полимеры со слабыми, преимущественно ван-дер-ваальсовскими связями. Рассматриваемое ниже относится преимущечтвенно к системам второго типа.
А) Однокомпонентные системы (чистые вещества).
В случае чистых веществ, способных находиться в парообразном, жидком и кристаллическом (твердом) (п-ж-т) состояниях равновесному сосуществованию двух фаз (п-ж, п-т, ж-т или т-т) и точке фазового перехода 1-го рода соответствует равенство нулю разности мольных свободных энергий фаз (ΔGm=0), т.е. пересечению кривых зависимостей мольных свободных энергий фаз от температуры (при постоянном давлении). Слева от точки пересечения (при более низкой температуре) мольная свободная энергия 2-й фазы (например, жидкой в системе п-ж и твердой - в системе ж-т) меньше, чем 1-й фазы (парообразной и жидкой соответственно), а справа (при более высокой температуре) - наоборот. Следовательно, в равновесном состоянии при более низкой температуре должна быть термодинамически стабильна 2-я фаза, а при более высокой температуре - 1-я фаза. Точка пересечения кривых соответствует температурному фазовому переходу - превращению одной фазы в другую, что соответствует испарению/конденсации, возгонке/конденсации, кристаллизации/плавлению или превращению двух твердых фаз чистого вещества. В этой точке кривая мольной свободной энергии одной фазы плавно переходит в другую кривую, претерпевая излом, т.е. при фазовом превращении свободная энергия системы изменяется непрерывно (без скачка). Однако ее первые производные по интенсивным независимым переменным Т и р, (экстенсивные независимые переменные):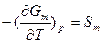 и
и 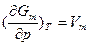 при таком превращении изменяются скачком. Такое превращение соответствует равновесному фазовому переходу 1-го рода при температуре
при таком превращении изменяются скачком. Такое превращение соответствует равновесному фазовому переходу 1-го рода при температуре 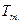 . В этом случае для изолированных материальных систем скачок энтропии в соответствии с фундаментальным определением энтропии (
. В этом случае для изолированных материальных систем скачок энтропии в соответствии с фундаментальным определением энтропии (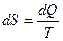 ) связан с мольной теплотой перехода
) связан с мольной теплотой перехода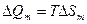 , обратной по знаку мольной энтальпии перехода
, обратной по знаку мольной энтальпии перехода 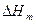 . Таким образом, фазовые переходы 1-го рода сопровождаются скачкообразным изменением объема и поглощением или выделением теплоты перехода. Если в 1-компонентной системе одновременно изменять температуру и давление таким образом, чтобы мольные свободные энергии фаз оставались одинаковыми, то в координатах Т-р две равновесно существующие фазы, разделяются линией (кривой) сосуществования, дифференциальное уравнение которой соответствует уравнению Клаузиуса-Клапейрона. Это уравнение выведено с использованием уравнения Гиббса-Дюгема при условии равенства мольных свободных энергий сосуществующих фаз:
. Таким образом, фазовые переходы 1-го рода сопровождаются скачкообразным изменением объема и поглощением или выделением теплоты перехода. Если в 1-компонентной системе одновременно изменять температуру и давление таким образом, чтобы мольные свободные энергии фаз оставались одинаковыми, то в координатах Т-р две равновесно существующие фазы, разделяются линией (кривой) сосуществования, дифференциальное уравнение которой соответствует уравнению Клаузиуса-Клапейрона. Это уравнение выведено с использованием уравнения Гиббса-Дюгема при условии равенства мольных свободных энергий сосуществующих фаз: 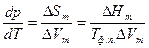 , где
, где 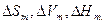 - разности мольных энтропий, объемов и энтальпий между двумя фазами соответственно. Величина
- разности мольных энтропий, объемов и энтальпий между двумя фазами соответственно. Величина 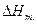 соответствует мольной энтальпии фазового перехода. Для одновременно сосуществующих трех фаз (например, парообразной, жидкой и твердой) в 1-компонентной системе производная
соответствует мольной энтальпии фазового перехода. Для одновременно сосуществующих трех фаз (например, парообразной, жидкой и твердой) в 1-компонентной системе производная 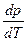 изменяется скачком, и кривые сосуществования двух фаз сходятся в одной точке, называемой тройной, т.е. каждая кривая претерпевает излом. Равновесная (термодинамическая) температура (точка) фазового перехода Tm определяется из условия равенства нулю разности свободной энергии Гиббса для двух сосуществующих и находящихся в равновесии фаз в точке перехода:
изменяется скачком, и кривые сосуществования двух фаз сходятся в одной точке, называемой тройной, т.е. каждая кривая претерпевает излом. Равновесная (термодинамическая) температура (точка) фазового перехода Tm определяется из условия равенства нулю разности свободной энергии Гиббса для двух сосуществующих и находящихся в равновесии фаз в точке перехода: 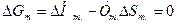 , т.е.
, т.е. 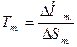 . Зависимость температуры фазового перехода Tm от давления описывается рассмотренным выше уравнением Клаузиуса-Клапейрона. При температуре фазового перехода первого рода из-за скрытой теплоты и неизменности температуры вторые производные свободной энергии, в частности, удельная теплоемкость
. Зависимость температуры фазового перехода Tm от давления описывается рассмотренным выше уравнением Клаузиуса-Клапейрона. При температуре фазового перехода первого рода из-за скрытой теплоты и неизменности температуры вторые производные свободной энергии, в частности, удельная теплоемкость 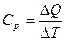 претерпевает «сингулярность, т.е. обращается в бесконечность, так как
претерпевает «сингулярность, т.е. обращается в бесконечность, так как 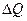 - подводимая или отводимая теплота, равная скрытой теплоте фазового перехода, а ΔТ =0, так при фазовом переходе Т остается постоянной.
- подводимая или отводимая теплота, равная скрытой теплоте фазового перехода, а ΔТ =0, так при фазовом переходе Т остается постоянной.
Если рассматривать изобарно-изотермический фазовый переход 1-го рода между двумя фазами однокомпонентной системы как реакцию α→β, то мольную свободную энергию этого процесса можно рассчитать по выражению, полученному решением уравнения Гиббса-Гельмгольца: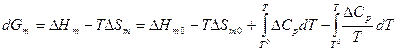 , где
, где 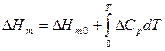 ,
, 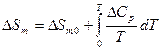
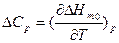 ;
; 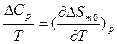 ;
; 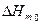 и
и 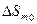 - мольная энтальпия и энтропия процесса при 0 К соответственно. Анализ этих соотношений позволил Нернсту сформулировать так называемый тепловой закон для изобарно-изотермического процесса α→β:
- мольная энтальпия и энтропия процесса при 0 К соответственно. Анализ этих соотношений позволил Нернсту сформулировать так называемый тепловой закон для изобарно-изотермического процесса α→β: 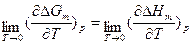 или ΔSm0=0, который связан с постулатом о недостижимости абсолютного нуля.
или ΔSm0=0, который связан с постулатом о недостижимости абсолютного нуля.
С позиций термодинамической устойчивости материальных однокомпонентных систем к флуктуациям равновесные фазовые переходы 1-го рода, в частности переходы из жидкого, или аморфного, в кристаллическое состояние, рассматриваются как потеря устойчивости к флуктуациям больше некоторого критического размера (образование стабильно растущего зародыша новой фазы), определяемого вкладом в общее изменение свободной энергии объемного (отрицательного) и поверхностного (положительного) вклада при увеличении размера флуктуаций: 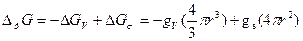 , где gv, gs – соответственно, удельная объемная (на единицу объема) и поверхностная (на единицу поверхности) свободная энергия при заданных условиях, r – радиус флуктуации. Для флуктуации, содержащей n частиц:
, где gv, gs – соответственно, удельная объемная (на единицу объема) и поверхностная (на единицу поверхности) свободная энергия при заданных условиях, r – радиус флуктуации. Для флуктуации, содержащей n частиц: 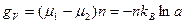 и
и 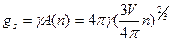 , где
, где 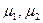 - химические потенциалы фаз, приходящиеся на молекулу; а – активность пара, переохлаждение или пересыщение; А(n) – площадь поверхности флуктуации; V – мольный объем конденсированной фазы; γ – удельная межфазная энергия. Условие потери устойчивости системы к флуктуациям и формирования устойчивых зародышей новой фазы соответствует максимальному положительному значению суммарной
- химические потенциалы фаз, приходящиеся на молекулу; а – активность пара, переохлаждение или пересыщение; А(n) – площадь поверхности флуктуации; V – мольный объем конденсированной фазы; γ – удельная межфазная энергия. Условие потери устойчивости системы к флуктуациям и формирования устойчивых зародышей новой фазы соответствует максимальному положительному значению суммарной 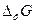 при некотором критическом значении
при некотором критическом значении 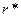 , после которого она начинает уменьшаться. Энергетический барьер, который должна преодолеть флуктуация для формирования зародыша критического размера, число частиц в нем и его радиус равны соответственно:
, после которого она начинает уменьшаться. Энергетический барьер, который должна преодолеть флуктуация для формирования зародыша критического размера, число частиц в нем и его радиус равны соответственно:
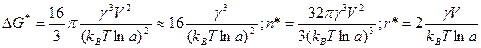 .
.
Классическим примером неустойчивого состояния (потери механической устойчивости) в условиях, далеких от равновесия, и критического непрерывного перехода является переход чистого вещества в критическое состояние в результате фазового перехода второго рода при критических температуре и давлении. Критическое состояние жидкость-пар, в котором отсутствует четкая граница раздела, может существовать в некоторых областях изотерм p-V и обобщенной диаграммы p-V-Т. Устойчивые равновесные состояния жидкость-пар и пар-жидкость могут существовать только в тех случаях, когда выполняется условие (85):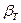 >0 или
>0 или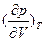 <0. При условии
<0. При условии 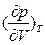 >0 состояние жидкость-пар является неустойчивым: жидкость находится в перегретом метастабильном состоянии (до минимума справа на изотерме p-V, при котором
>0 состояние жидкость-пар является неустойчивым: жидкость находится в перегретом метастабильном состоянии (до минимума справа на изотерме p-V, при котором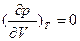 ), а пар – в пересыщенном состоянии (после максимума справа на изотерме p-V, при котором
), а пар – в пересыщенном состоянии (после максимума справа на изотерме p-V, при котором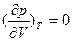 ). Температура, при которой на изотерме p-V исчезает минимум и максимум и появляется точкаперегиба
). Температура, при которой на изотерме p-V исчезает минимум и максимум и появляется точкаперегиба 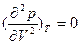 соответствует критической точке Тс, а область между минимумами и максимумами изотерм – нестабильной области критического состояния.
соответствует критической точке Тс, а область между минимумами и максимумами изотерм – нестабильной области критического состояния.
Другим классическим примером возможности перехода в нестабильное состояние и критического поведения является спинодальное расслоение (распад) бинарных растворов двух ограниченно растворимых жидкостей. Условием стабильности (устойчивости к флуктуациям концентрации) таких растворов служит неравенство (86): 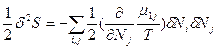 <0. Термодинамические расчеты, проведенные для нормальных бинарных смесей органических жидкостей, в том числе полимеров, формулируют ют это условие в следующем виде:
<0. Термодинамические расчеты, проведенные для нормальных бинарных смесей органических жидкостей, в том числе полимеров, формулируют ют это условие в следующем виде: 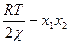 >0 (88), где, х1, х2 - мольные доли компонентов (х1 + х2 =1); χ – параметр взаимодействия компонентов, учитывающий различия в энергии их межмолекулярного взаимодействия (константа, слабо зависящая от температуры и соотношения компонентов),
>0 (88), где, х1, х2 - мольные доли компонентов (х1 + х2 =1); χ – параметр взаимодействия компонентов, учитывающий различия в энергии их межмолекулярного взаимодействия (константа, слабо зависящая от температуры и соотношения компонентов), 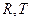 - газовая постоянная и температура соответственно. Так как обычно
- газовая постоянная и температура соответственно. Так как обычно 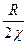 >0, а произведение х1х2 - мало, то при достаточно высокой температуре условие стабильности выполняется в широком диапазоне соотношений компонентов. При низких Т это условие может нарушаться, система становится неустойчивой флуктуациям концентрации и способна разделяться на две фазы в результате неограниченного роста таких флуктуаций. Соотношение
>0, а произведение х1х2 - мало, то при достаточно высокой температуре условие стабильности выполняется в широком диапазоне соотношений компонентов. При низких Т это условие может нарушаться, система становится неустойчивой флуктуациям концентрации и способна разделяться на две фазы в результате неограниченного роста таких флуктуаций. Соотношение 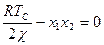 (89) определяет критическую температуру нестабильности смеси как функцию состава (при заданном χ). Линии на диаграмме состояния в координатах температура состав, проходящие через Тс (сходящиеся в ней), разделяют устойчивую область от метастабильной (бинодаль) и метастабильную от неустойчивой (спинодаль). Бинодаль получают, приравнивая химические потенциалы компонентов в двух фазах, а спинодаль определяется функцией
(89) определяет критическую температуру нестабильности смеси как функцию состава (при заданном χ). Линии на диаграмме состояния в координатах температура состав, проходящие через Тс (сходящиеся в ней), разделяют устойчивую область от метастабильной (бинодаль) и метастабильную от неустойчивой (спинодаль). Бинодаль получают, приравнивая химические потенциалы компонентов в двух фазах, а спинодаль определяется функцией 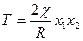 (90). В критической точке и в области неустойчивости (ниже спинодали) флуктуации концентрации критически растут, т.е. происходит выделение (на начальной стадии спинодального распада) в растворе растущих (без активационного потенциального барьера) флуктуаций с повышенной концентрацией одного из компонентов в среде с его пониженной концентрацией, т.е. происходит как бы непрерывное перерождение системы из гомогенного состояния в гетерофазное. Этот процесс на начальной стадии протекает со всеми характерными особенностями критических явлений, обусловленными скоррелирванным на большие расстояния кооперативным движением молекул. На предельных стадиях в системе устанавливается равновесное распределение фаз и компонентов в них. В метастабильной области (между бинодалью и спинодалью) разделение фаз возможно только как классический фазовый переход первого рода в результате превышения флуктуациями концентрации некоторого критического размера с преодолением потенциального барьера зарождения, или нуклеации и роста новой фазы.
(90). В критической точке и в области неустойчивости (ниже спинодали) флуктуации концентрации критически растут, т.е. происходит выделение (на начальной стадии спинодального распада) в растворе растущих (без активационного потенциального барьера) флуктуаций с повышенной концентрацией одного из компонентов в среде с его пониженной концентрацией, т.е. происходит как бы непрерывное перерождение системы из гомогенного состояния в гетерофазное. Этот процесс на начальной стадии протекает со всеми характерными особенностями критических явлений, обусловленными скоррелирванным на большие расстояния кооперативным движением молекул. На предельных стадиях в системе устанавливается равновесное распределение фаз и компонентов в них. В метастабильной области (между бинодалью и спинодалью) разделение фаз возможно только как классический фазовый переход первого рода в результате превышения флуктуациями концентрации некоторого критического размера с преодолением потенциального барьера зарождения, или нуклеации и роста новой фазы.
По современным представлениям в метастабильных, сильно переохлажденных ниже равновесной температуры кристаллизации (некристаллизующихся или трудно кристаллизующихся) однокомпонентных (чистых) жидкостях (расплавах) также возможен критический спинодальный распад в результате критического роста флуктуаций плотности. Эти представления базируются на концепции метастабильной фазовой границы и наличия кривых метастабильного сосуществования двух жидких фаз (линии бинодали) и их термодинамической нестабильности (линии спинодали), скрытых внутри области равновесного сосуществования жидкой и кристаллической фаз. При достаточно большом переохлаждения расплава ниже равновесной температуры плавления Tm возможно пересечение линии спинодали с переходом расплава в нестабильную область и его критическим распадом на более упорядоченную твердоподобную и менее упорядоченную жидкоподобную фазы вследствие критического (непрерывного безактивационного) роста флуктуаций плотности (твердоподобных доменов) в менее упорядоченной (жидкоподобной) среде. Твердоподобные домены образуются из более способных к упорядоченной упаковке низкотемпературных транс- конформаций молекул (транс- конформеров), которые, в свою очередь, образуются из менее способных к упорядоченной упаковке более высокотемпературных гош- конформаций молекул (гош- конформеров) в результате конформационных гош/транс превращений при понижении температуры.
Теоретическое построение линий бинодали и спинодали сильно переохлажденной жидкости (без учета линии кристаллизации) базируется на расчете удельной свободной энергии Гельмгольца в зависимости от средней массовой плотности жидкости 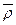 и доли транс -конформаций η и на определении изобар в координатах Т -
и доли транс -конформаций η и на определении изобар в координатах Т -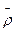 по уравнению состояния
по уравнению состояния 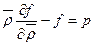 (91). При этом свободная энергия, приходящаяся на единицу объема, складывается из двух компонентов:
(91). При этом свободная энергия, приходящаяся на единицу объема, складывается из двух компонентов: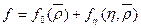 . Первый член в уравнении свободной энергии
. Первый член в уравнении свободной энергии 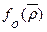 представляет собой свободную энергию жидкости при η=0, а второй член
представляет собой свободную энергию жидкости при η=0, а второй член 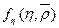 - при η ≠ 0, т.е.с учетом распределения конформеров. Кривая f как функция
- при η ≠ 0, т.е.с учетом распределения конформеров. Кривая f как функция 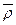 , имеющая при высокой температуре один минимум, при некоторой критической температуре Тс разделяется на два минимума, соответствующих двум сосуществующим термодинамически стабильным состояниям, причем точки минимумов на кривых f (
, имеющая при высокой температуре один минимум, при некоторой критической температуре Тс разделяется на два минимума, соответствующих двум сосуществующим термодинамически стабильным состояниям, причем точки минимумов на кривых f (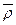 ) соответствуют линии бинодали, а точки перегибов – линии спинодали, которые сходятся в критической точке Тс. При критической и более низкой температуре, т.е. в области ниже спинодали, должен происходить спинодальный распад сильно переохлажденной жидкости (расплава) в результате неограниченного роста твердоподобных флуктуаций. Физически это соответствует тому, что в системе уменьшается конформационная энтропия, и в среде, образованной преимущественно гош- конформерами, начинают спонтанно выделяться образующиеся из транс- конформеров более плотные домены. Спинодальный распад сильно переохлажденной жидкости может служить начальной стадией образования зародышей кристаллизации или при дальнейшем охлаждении (при неспособности жидкости, вследствие стерических или кинетических ограничений, образовывать сверхкритические зародыши кристаллизации) быть причиной стеклования жидкости из-за резкого возрастания времени релаксации при образовании твердопоподобных доменов и замораживания молекулярного теплового движения.
) соответствуют линии бинодали, а точки перегибов – линии спинодали, которые сходятся в критической точке Тс. При критической и более низкой температуре, т.е. в области ниже спинодали, должен происходить спинодальный распад сильно переохлажденной жидкости (расплава) в результате неограниченного роста твердоподобных флуктуаций. Физически это соответствует тому, что в системе уменьшается конформационная энтропия, и в среде, образованной преимущественно гош- конформерами, начинают спонтанно выделяться образующиеся из транс- конформеров более плотные домены. Спинодальный распад сильно переохлажденной жидкости может служить начальной стадией образования зародышей кристаллизации или при дальнейшем охлаждении (при неспособности жидкости, вследствие стерических или кинетических ограничений, образовывать сверхкритические зародыши кристаллизации) быть причиной стеклования жидкости из-за резкого возрастания времени релаксации при образовании твердопоподобных доменов и замораживания молекулярного теплового движения.
Классические термодинамические теории стеклования базируются на экспериментально установленных фактах об отклонении (уходе) при стекловании в узком температурном интервале экстенсивных параметров (S,H,V) от равновесной для жидкого состояния кривой их температурной зависимости (Рис.1-2). При этом их производные по интенсивным параметрам (температуре и давлению), в частности теплоемкость, претерпевают изменение, близкое к ступенчатому (Рис.3), а если проэкстраполировать температурную зависимость разности энтропий жидкости и кристалла Δ S(Т) в область низких температур, то она обращается в нуль при конечной, сравнительно высокой температуре (парадокс Козмана - см. Рис.2). При приближении равновесным способом переохлажденной некристаллизующей жидкости к этой температуре (Тк) жидкость должна претерпеть фазовый переход 2-го рода с плавным приближением ее энтропии к энтропии кристалла. В основополагающей теории Адама-Гиббса уменьшение энтропии жидкости при приближении к Тк обусловлено резким уменьшением так называемого конфигурационного вклада в энтропию.
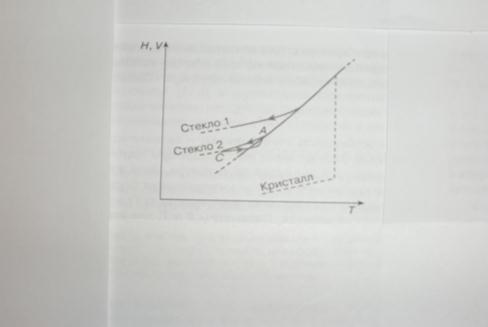
Рис.1. Температурные зависимости энтальпии и объема (H,V) некристаллизующейся жидкости при переохлаждении с различной скоростью: Стекло1- быстрое охлаждение; Стекло 2- медленное охлаждение (пунктиром показано их изменение при кристаллизации).
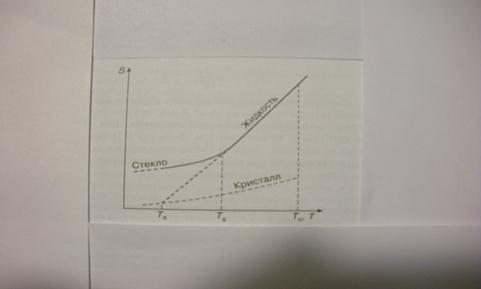
Рис.2. Температурные зависимости энтропии (S) некристаллизующейся жидкости при переохлаждении: Тcr – температура кристаллизации; Тg – температура стеклования; Тк – температура, при которой энтропия жидкости сравнивается с энтропией кристалла (эффект Козмана).
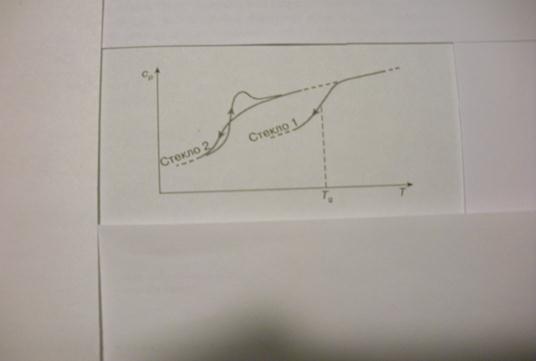
Рис.3. Температурные зависимости мольной теплоемкости при постоянном давлении некристаллизующейся жидкости при переохлаждении ниже Тg (кривые 1-2, стрелки влево, кривая 1 – при быстром, кривая 2 – при медленном охлаждении) и при обратном нагревании (кривая 2, стрелка направо).
Адам и Гиббс связали уменьшение конфигурационной энтропии жидкости при приближении к Тк с резким возрастанием роли кооперативных явлений при релаксации к равновесным конфигурациям вследствие образования твердоподобных флуктуаций. Элементарным независимым объектом релаксации при этом становится не один первичный структурный элемент (молекула или сегмент), а группа из Z таких элементов (флуктуация плотности), которая перестраивается как единое целое. При понижении температуры ниже 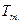 количество таких элементов в группах возрастает, что приводит к резкому уменьшению числа микросостояний и, следовательно, вклада конфигурационной энтропии. В простейшем случае, если связать с каждой группой из Z элементов два состояния (до и после замораживания крупномасштабной формы теплового движения), то конфигурационная энтропия для одного моля первичных элементов (числа Авогадро) равна:
количество таких элементов в группах возрастает, что приводит к резкому уменьшению числа микросостояний и, следовательно, вклада конфигурационной энтропии. В простейшем случае, если связать с каждой группой из Z элементов два состояния (до и после замораживания крупномасштабной формы теплового движения), то конфигурационная энтропия для одного моля первичных элементов (числа Авогадро) равна: 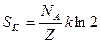 . Очевидно, что при уменьшении конфигурационной энтропии размер групп растет и может достигать макроскопических величин. Исходя из предположения, что конфигурационная энтропия обращается в нуль при Тк, то
. Очевидно, что при уменьшении конфигурационной энтропии размер групп растет и может достигать макроскопических величин. Исходя из предположения, что конфигурационная энтропия обращается в нуль при Тк, то 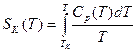 , где Ср(Т) – зависимость конфигурационной теплоемкости при постоянном давлении от температуры. Конфигурационная теплоемкость, как и конфигурационная энтропия и энтальпия, связана с релаксацией системы к равновесным конфигурациям и в значительной мере определяет уменьшение теплоемкости жидкости при ее переохлаждении. Энтропия и энтальпия при незавершенной релаксации (при ξ<1, где ξ – степень полноты прохождения конфигурационных превращений типа «транс»/»гош» переходов), т.е. после ухода от равновесной для жидкого состояния кривой их температурной зависимости (см. Рис.1-2) всегда меньше их значений в равновесном состоянии, когда ξ=1, а температура ухода от равновесных значений тем ниже, чем меньше скорость охлаждения. Измеряемая теплоемкость при незавершенной релаксации, т.е. при ξ<1, также всегда меньше теплоемкости в равновесном состоянии при ξ=1, а е изменение при переходе несколько увеличивается с уменьшением скорости охлаждения. Как видно из рис.3 вблизи Тк, которую считают термодинамической температурой стеклования, функция Ср(Т) имеет довольно сложный характер и зависит от темпа (скорости) охлаждения. В предположении простой обратно пропорциональной зависимости Ср(Т)=А/Т:
, где Ср(Т) – зависимость конфигурационной теплоемкости при постоянном давлении от температуры. Конфигурационная теплоемкость, как и конфигурационная энтропия и энтальпия, связана с релаксацией системы к равновесным конфигурациям и в значительной мере определяет уменьшение теплоемкости жидкости при ее переохлаждении. Энтропия и энтальпия при незавершенной релаксации (при ξ<1, где ξ – степень полноты прохождения конфигурационных превращений типа «транс»/»гош» переходов), т.е. после ухода от равновесной для жидкого состояния кривой их температурной зависимости (см. Рис.1-2) всегда меньше их значений в равновесном состоянии, когда ξ=1, а температура ухода от равновесных значений тем ниже, чем меньше скорость охлаждения. Измеряемая теплоемкость при незавершенной релаксации, т.е. при ξ<1, также всегда меньше теплоемкости в равновесном состоянии при ξ=1, а е изменение при переходе несколько увеличивается с уменьшением скорости охлаждения. Как видно из рис.3 вблизи Тк, которую считают термодинамической температурой стеклования, функция Ср(Т) имеет довольно сложный характер и зависит от темпа (скорости) охлаждения. В предположении простой обратно пропорциональной зависимости Ср(Т)=А/Т: 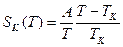 , и при Т → Тк SK →0. Температурная зависимость времени релаксации перехода к равновесным конфигурациям, определенная из предположения, что энергия активации такого процесса для элементарной группы пропорциональна ее размеру, описывается экспоненциальной функцией
, и при Т → Тк SK →0. Температурная зависимость времени релаксации перехода к равновесным конфигурациям, определенная из предположения, что энергия активации такого процесса для элементарной группы пропорциональна ее размеру, описывается экспоненциальной функцией 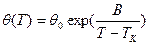 , где θ0 и В – константы, причем
, где θ0 и В – константы, причем 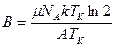 . Эта функция аналогична известной эмпирической формуле Фогеля-Фалчера-Таммана (ФФТ)
. Эта функция аналогична известной эмпирической формуле Фогеля-Фалчера-Таммана (ФФТ) 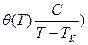 , в соответствие с которой при Т → Тк θ →∞. Из этого следует, что при приближении к Тк,, равновесное состояние не может быть достигнуто при любом самом большом характерном для эксперимента временем изменения температуры tэ время релаксации превысит его, и жидкость окажется в замороженном неравновесном (стеклообразном) состоянии, когда тип движения, ответственный за установление равновесных конфигураций, становится слишком медленным, чтобы успевать подстраиваться к изменению температуры. Поэтому стеклование как термодинамический переход второго рода, если он существует, является на практике скрытым, т.е. практически ненаблюдаемым и всегда проявляется как динамический, или кинетический переход, температура которого зависит от временных условий эксперимента.
, в соответствие с которой при Т → Тк θ →∞. Из этого следует, что при приближении к Тк,, равновесное состояние не может быть достигнуто при любом самом большом характерном для эксперимента временем изменения температуры tэ время релаксации превысит его, и жидкость окажется в замороженном неравновесном (стеклообразном) состоянии, когда тип движения, ответственный за установление равновесных конфигураций, становится слишком медленным, чтобы успевать подстраиваться к изменению температуры. Поэтому стеклование как термодинамический переход второго рода, если он существует, является на практике скрытым, т.е. практически ненаблюдаемым и всегда проявляется как динамический, или кинетический переход, температура которого зависит от временных условий эксперимента.
 2014-02-18
2014-02-18 1157
1157







