Соосаждение, как метод разделения и концентрирования.
Выпаривание, как метод концентрирования.
Адсорбционные методы концентрирования (адсорбция на оксицеллюлозе, стеклянной вате)
Сорбция
Экстракция
Хроматографические методы разделения и концентрирования.
Недостаточная чувствительность аналитических реакций и методов обусловливает необходимость проведения операций предварительного разделения и концентрирования компонент анализируемой пробы.
Концентрирование применяют для повышения концентрации исследуемого вещества до пределов, при которых возможно определение анализируемого компонента тем или иным методом. Сущность концентрирования заключается в следующем: выделить определяемое вещество из большого объема исследуемого раствора и собрать его в малом объеме концентрата. Если 100 мл анализируемой природной воды подвергнуть соответствующей обработке, в результате которой получен 1 мл концентрата, то в последнем концентрация определяемого вещества в 100 раз выше, чем в природной воде. В этом случае коэффициент обогащения равен 100. Отсюда следует, что при прочих равных условиях желательно, чтобы взятый объем исходной природной воды был по возможности большим, а объем полученного концентрата - по возможности меньшим. Например, для определения урана в морской воде объем пробы достигает 100 л.
Способы концентрирования должны отличаться необходимой специфичностью: желательно, чтобы в концентрате было только то вещество, которое необходимо определять. Это требование обусловлено тем, что даже самые чувствительные реакции оказываются непригодными в случае, если в анализируемой среде присутствует несколько компонентов, которые могут взаимодействовать с с применяемыми реактивами или изменяют ионную силу раствора, имеют собственную окраску и таким образом мешают определению. Следовательно, кроме чувствительности, необходимо знать и так называемые «предельные отношения» - максимальное отношение между количествами определяемого элемента и другими элементами, при котором можно определить анализируемых компонент без предварительного отделения его от других. Например, в анализируемой пробе содержатся ионы никеля и кобальта. Анализируемый компонент – никель. Мешает определению кобальт. Предельное отношение 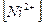 :
: 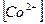 = 1: 1000. Следовательно, применяемая аналитическая реакция дает возможность обнаружить или определить никель при условии, что содержание кобальта в этой же пробе превышает содержание никеля не более, чем в 1000 раз. При больших количествах кобальта требуется его отделение от никеля. Таким образом, данный пример показывает, что методы концентрирования должны одновременно обеспечивать и разделение веществ. Для концентрирования и разделения веществ чаще применяют методы, основанные на распределении вещества между двумя несмешивающимися фазами.
= 1: 1000. Следовательно, применяемая аналитическая реакция дает возможность обнаружить или определить никель при условии, что содержание кобальта в этой же пробе превышает содержание никеля не более, чем в 1000 раз. При больших количествах кобальта требуется его отделение от никеля. Таким образом, данный пример показывает, что методы концентрирования должны одновременно обеспечивать и разделение веществ. Для концентрирования и разделения веществ чаще применяют методы, основанные на распределении вещества между двумя несмешивающимися фазами.
Некоторые методы разделения и концентрирования веществ,
Экстрагирование – извлечение малых количеств веществ из относительно большого объема водного раствора небольшим объемом практически несмешивающегося с водой органического растворителя, в котором растворимость исследуемого вещества больше, чем в воде.
|





 | ||||||||||||||
 | ||||||||||||||
 | ||||||||||||||
 | ||||||||||||||
 | ||||||||||||||
 | ||||||||||||||
 |
Экстрагирование – удобный и селективный метод отделения малых количеств загрязнений от основных компонентов пробы. Распространение этого способа концентрирования объясняется простотой операций, быстротой их выполнения, возможности отделения одного вещества (или группы веществ) от большого количества других веществ. При экстракции можно повысить концентрацию вещества в растворе в 200 – 400 раз. Коэффициент распределения экстрагируемого вещества между водной и неводной фазами часто остается практически постоянным при изменении концентрации раствора. При полном извлечении некоторого окрашенного вещества из V мл водного раствора в значительно меньший объем V1 мл органического растворителя достигается повышение концентрации в V/V1 раз. При этом чувствительность реакции может повыситься значительно больше. Например, если к 3 мл раствора молибдата прибавить 1 мл концентрированной соляной кислоты и несколько капель насыщенного этанольного раствора дифенилкарбазида, то появляется розовая окраска, заметная только при концентрации молибдата не ниже 1:1500. Если же взболтать этот раствор с 1 мл диэтилового эфира, то эфирный слой окрашивается в ярко красный цвет, заметный даже при концентрации 1: 2,3×106. Вместо ожидаемого увеличения чувствительности в 4 раза здесь наблюдается увеличение чувствительности в 1500 раз. Повышение чувствительности реакции более, чем в V/V1 раз, можно объяснить тем, что окрашенное соединение в водной среде хорошо диссоциирует с образованием бесцветных продуктов, а в среде органического растворителя диссоциация уменьшается. Кроме того, возможно, что молекулы органического растворителя входят в состав продукта реакции и что состав окрашенного вещества в органическом растворителе и в водной среде различен.
Условия разделения некоторых ионов путем экстрагирования из водных растворов
| Экстрагируемый ион | Ионы, от которых отделяют | Водная фаза | экстрагент |
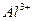
| 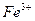
| 8-оксихинолин | хлороформ |
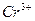
| 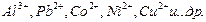
| 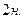 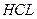
| метилизобутилкетон |
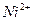
| 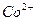 и др. и др.
| Диметилглиоксим, КОН | хлороформ |
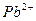
| 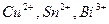 и др. и др.
| 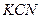 , рН 8-10 , рН 8-10
| Раствор дитизона в в хлороформе |
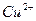
|
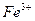
| KH2PO4 | Раствор дифенилкарбазона в в бензоле |
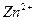
|
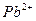 и др. и др.
| HNO3, NH4SCN Пиридин, NH4SCN | Диэтиловый эфир Хлороформ |
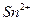
| 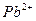
| 1 н. НС1, 2 н. NH4SCN | Диэтиловый эфир |
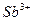
| 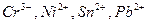
| 6 н. НС1 | Этилацетат |

|

|
В большинстве случаев экстрагируют примеси, которые таким способом отделяют от элемента-основы. Иногда экстрагируют основу и в остатке определяют примеси. Например, при определении примесей в железе последнее в виде FeCl3 удаляют экстрагированием диэтиловым эфиром или же при анализе бериллия его отделяют от примесей экстрагированием основного ацетата бериллия хлороформом. Этот путь является менее приемлемым, так как небольшие количества примесей могут частично экстрагироваться вместе с основой.
При некоторых условиях нередко экстрагируется целая группа ионов. Например, экстрагирование хлороформом при рН 3, затем при рН 5 и рН 7 после добавления растворов 8-оксихинолина и дитизона позволяет определять примесь 30 элементов в селене. Эти же примеси удается выделить и определить при анализе щелочных и щелочноземельных металлов и их солей.
 2014-02-09
2014-02-09 685
685








