Ответы
Задачи
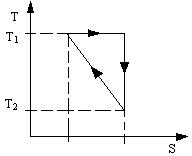
 3.1. Произвольное рабочее вещество совершает цикл, в пределах которого абсолютная температура изменяется в α раз. Цикл имеет вид изображенный на рис.15: T – температура, S – энтропия. Найти КПД цикла.
3.1. Произвольное рабочее вещество совершает цикл, в пределах которого абсолютная температура изменяется в α раз. Цикл имеет вид изображенный на рис.15: T – температура, S – энтропия. Найти КПД цикла.
|
3.3. Найти приращение энтропии алюминиевого бруска массы m=3.0кг при нагревании его от Т1=300˚К до Т2=600˚К, если в этом интервале температур удельная теплоемкость алюминия с=а+bТ, где а=0,77Дж/гК, b=0.46мДж/гК2.
3.4. Вычислить изменения внутренней энергии и энтропии одного моля идеального газа при расширении по политропе pVn=const от объема V1 до объема V2. рассмотреть частные случаи изотермического и адиабатического процессов.
3.5. Гелий массы m=1,7г адиабатически расширили в n=3 раза и затем изобарически сжали до первоначального объема. Найти приращение энтропии газа в этом процессе.
|
|
|
3.6. В двух сосудах одного и того же объема находятся различные идеальные газы. Масса газа в первом сосуде М1, во втором М2, давления газов и их температуры одинаковы. Сосуды соединили друг с другом и начался процесс диффузии. Определить суммарное изменение ∆S энтропии рассматриваемой системы, если относительная молекулярная масса первого газа μ1, а второго μ2.
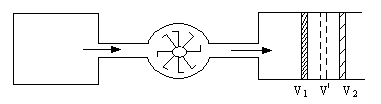
3.7. Идеальный одноатомный газ в количестве υ=10 молей,
находящийся при температуре Т1=300˚К, расширяется без подвода и отдачи тепла в пустой сосуд через турбину, необратимым образом совершая работу (рис.16) После установления равновесия температура газа понижается до Т=200˚К.
|
После этого газ квазистатически сжимается: сначала изотермически, а затем адиабатически, возвращаясь в первоначальное состояние. При этом сжатии затрачивается работа А=15кДж. Найти изменение энтропии газа при расширении.
3.8. Вычислить изменение энтропии при смешении одноатомного идеального газа массы m1, имеющего начальную температуру Т1 и давление p1, и двухатомного газа массы m2, имеющего начальные температуру Т2 и давление p2. Молярные массы смешиваемых газов М1 и М2.
3.1. 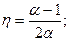
3.2. 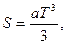
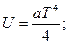
3.3. 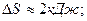
3.4. 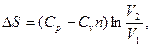
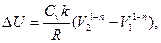
где k=const;
3.5. 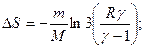
3.6. 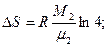
3.7. 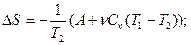
3.8. 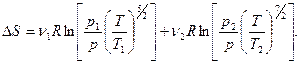
 Уравнение состояния газа Клапейрона-Менделеева имеет ограниченную область применимости, поскольку не учитывает межмолекулярные взаимодействия. В реальных газах есть дальнодействующие силы притяжения и короткодействующие силы отталкивания. Взаимодействие в газах приводит к количественным и качественным отклонениям от поведения, предсказываемого уравнением Клапейрона-Менделеева.
Уравнение состояния газа Клапейрона-Менделеева имеет ограниченную область применимости, поскольку не учитывает межмолекулярные взаимодействия. В реальных газах есть дальнодействующие силы притяжения и короткодействующие силы отталкивания. Взаимодействие в газах приводит к количественным и качественным отклонениям от поведения, предсказываемого уравнением Клапейрона-Менделеева.
|
|
|
Существует множество уравнений реальных газов, адекватно описывающих их свойства, включая превращение в жидкость. Это уравнения Ван-дер-Ваальса, Дитеричи (16), Бертло (17), Клаузиуса (18). Наиболее популярные в современной научной практике уравнения Редлиха-Квонга, Пенга-Робинсона, Камерлинг-Оннеса, или вириальное уравнение (19).
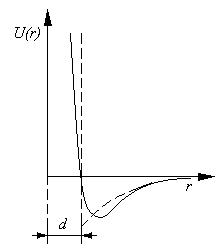
Уравнение Ван-дер-Ваальса имеет наиболее простую и физически ясную структуру, позволяющую сравнительно легко получать решение в аналитической форме. По этим причинам на семинаре мы ограничимся рассмотрением именно этого уравнения. Исторически это было первое уравнение состояния неидеального газа, поэтому наш выбор отражает также и почтение к его автору. Взаимодействие молекул на далеких и близких расстояниях удобно характеризовать потенциальной энергией взаимодействия 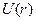 , функцией расстояния r между центрами молекул (рис.17).
, функцией расстояния r между центрами молекул (рис.17).

Функция имеет минимум, в котором силы притяжения уравновешиваются силами отталкивания. Аналитический вид функции 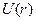 на полуэмпирической основе представлен ниже:
на полуэмпирической основе представлен ниже:
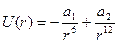 - потенциал Леннарда-Джонса (20)
- потенциал Леннарда-Джонса (20)
В теории Ван-дер-Ваальса используется упрощенная модель межмолекулярного взаимодействия, часть кривой 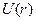 заменяется вертикальной прямой (пунктирная линия на рис.17). Если d – расстояние до этой прямой от начала координат, то центры взаимодействия частиц не могут сблизиться на расстояние, меньшее d, что соответствует модели твердых упругих шаров.
заменяется вертикальной прямой (пунктирная линия на рис.17). Если d – расстояние до этой прямой от начала координат, то центры взаимодействия частиц не могут сблизиться на расстояние, меньшее d, что соответствует модели твердых упругих шаров.
|

где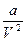 – поправка на давление, т.е. дополнительное «внутреннее» давление за счет взаимного притяжения; b – поправка на объем молекул, учитывающая силы отталкивания.
– поправка на давление, т.е. дополнительное «внутреннее» давление за счет взаимного притяжения; b – поправка на объем молекул, учитывающая силы отталкивания.
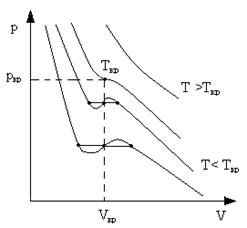 Наиболее содержательные результаты получаются из уравнения Ван-дер-Ваальса путем анализа его изотерм. Если в уравнении (19) принять Т = const, то изотерма этого уравнения в плоскости p, V пересекается прямой линией p = const либо в одной точке, либо в трех точках (рис.18). При некоторой промежуточной температуре Ткр три корня V1, V2, V3 становятся равными.
Наиболее содержательные результаты получаются из уравнения Ван-дер-Ваальса путем анализа его изотерм. Если в уравнении (19) принять Т = const, то изотерма этого уравнения в плоскости p, V пересекается прямой линией p = const либо в одной точке, либо в трех точках (рис.18). При некоторой промежуточной температуре Ткр три корня V1, V2, V3 становятся равными.
Такая температура и соответствующая ей изотерма называются критическими. Критическая изотерма всюду монотонно опускается вниз, за исключением одной точки – критической.
|
точке давление pk, объем Vk и температура Tk также называются критическими.
 2014-02-24
2014-02-24 1178
1178








