| Вещества | Н2О | N2 | О2 | Н2 | СО | СО2 |
| pк,МПа | 22,06 | 3,4 | 5,043 | 1,32 | 3,5 | 7,383 |
| Тк,К | 647,1 | 126,2 | 154,58 | 32,2 | 132,9 | 304,2 |
| vk ·103, м3/кг | 3,06 | 3,194 | 2,3 | 33,5 | 3,325 | 2,136 |
| Zк | 0,229 | 0,29 | 0,29 | 0,32 | 0,295 | 0,274 |
Примечание.
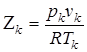 - коэффициент, показывающий насколько свойства реальных веществ в критическом состоянии отличаются от свойств идеального газа.
- коэффициент, показывающий насколько свойства реальных веществ в критическом состоянии отличаются от свойств идеального газа.
Если на диаграмме pv – p (рис. 2.1) отложить по оси абсцисс давление газа p, а по оси ординат произведение давления на удельный объем pv, то можно выделить следующее.
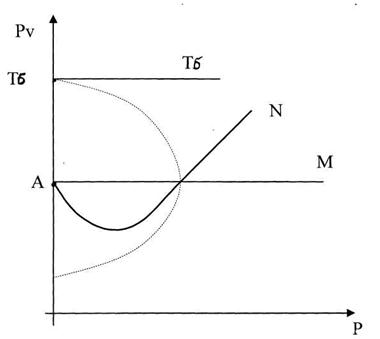
Рис. 2.1
Изотермы идеального газа изобразятся прямыми AM, параллельными оси абсцисс, как следует из уравнения состояния pv = RT, т.е. удельный объем изменяется обратно пропорционально давлению. Наличие сил взаимного притяжения между молекулами делает реальный газ более сжимаемым.
При р=0 любой реальный газ становится идеальным и его изотерма начинается в точке А. При низких давлениях, когда объем газа очень большой и влияние объема молекул невелико и действуют только силы взаимного притяжения, сжимаемость реальных газов увеличивается, и изотерма AN при малых р отклоняется вниз. В дальнейшем по мере увеличения давления уже нельзя пренебречь влиянием объема молекул и сжимаемость реального газа уменьшается, а изотерма AN отклоняется вверх.
|
|
|
 2014-02-24
2014-02-24 762
762








