Процессинг у эукариот затрагивает все виды первичных транскриптов эукариотических генов.
Процессинг у эукариот
Кэпирование представляет собой образование на 5'-конце мРНК особой структуры — кэпа (шапочки). Кэпирование происходит еще до полного завершения транскрипции и защищает 5'-конец РНК от действия нуклеаз. Кэпирование РНК осуществляется с участием GTP(гуанозинтрифосфата), из состава которого GMP переносится на 5'-дифосфат первого нуклеотида мРНК.
Полиаденилирование осуществляется, ферментом поли(А)-полимеразой и приводит к образованию на З'-конце олиго(А)-фрагмента, содержащего 100 — 200 остатков адениловой кислоты подряд и называемого также «поли(А)-хвостом». Эта поли (А)-последовательность добавляется к РНК после присоединения кэпа. Сначала 3'-конец РНК отщепляется ферментами в точке, отстоящей на 10-35 рибонуклеотидов от консервативной последовательности ААUААА, а затем происходит полиаденилирование этого конца молекулы РНК. Поли(А)-хвост находят практически у всех мРНКэукариотических ороганизмов, за исключением транскриптов гистоновых генов. Последовательность ААUААА встречается не во всех эукариотических РНК-транскриптах. По-видимому, это связано с мутациями, препятствующими полиаденилированию. В отсутствие 3'- хвоста РНК-транскрипты быстро деградируют под действием ферментов.
Т.о. 5'-кэп и 3'-хвост чрезвычайно важны для дальнейшего процессинга и транспортировки мРНК в цитоплазму. Поли(А)-хвост определяет стабильность мРНК и время ее жизни в клетке. Кроме того, способствует выходу мРНК из ядра в цитоплазму, а также существенен для регуляции трансляции.
Механизмы сплайсинга: автокатализ РНК (Клаг,400)
Для разных типов ядерной РНК, а также для РНК мтх и хлп существуют свои собственные механизмы сплайсинга.
В зависимости от специфичности механизма сплайсинга, интроны можно разделить на несколько групп. К первой группе относятся интроны, входящие в состав первичного рРНК-транскрипта, для удаления которых не требуется дополнительных компонентов. Эти интроны сами обладают ферментативной активностью, необходимой для их вырезания. Впервые этот факт был обнаружен в 1982 г (Томас Чех с сотр.) у жгутикового простейшего тетрахимены (Tetrachymena). Из-за автокаталитических свойств самосплайсирующиеся РНК иногда называют рибозимами.
Процесс самовырезания (автоэсцизия) (рис. 145_Коничев)
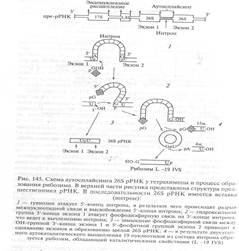 (рис.12-12, Клаг) представляет собой две нуклеофильные реакции, или реакции трансэтерификации, в которых гуанозин взаимодействует с первичным итранскриптом и действует как кофактор. При этом З'-гидроксильная группа гуанозина переносится на нуклеотид, примыкающий к 5'-концу интрона. Во второй реакции эта гидроксильная группа взаимодействуетс фосфатной группой на З'-конце правого интрона, в результате интрон вырезается, а концы двух соседних экзонов соединяются с образованием зрелой мРНК.
(рис.12-12, Клаг) представляет собой две нуклеофильные реакции, или реакции трансэтерификации, в которых гуанозин взаимодействует с первичным итранскриптом и действует как кофактор. При этом З'-гидроксильная группа гуанозина переносится на нуклеотид, примыкающий к 5'-концу интрона. Во второй реакции эта гидроксильная группа взаимодействуетс фосфатной группой на З'-конце правого интрона, в результате интрон вырезается, а концы двух соседних экзонов соединяются с образованием зрелой мРНК.
Интрон 26S рРНК тетрахимены — IVS, состоит из 413 нуклеотидов. В результате реакции трансэтерификации без дополнительных затрат энергии осуществляется лигирование двух экзонов с образованием зрелой 26S рРНК. Вырезанный интрон затем циклизуется. Из его состава путем двухэтапного ауторасщепления освобождается фрагмент, содержащий 19 нуклеотидов, в результате чего образуя РНК длиной 376 нуклеотидов (L -19 IVS), которая и представляет собой истинный РНК-фермент (рибозим), обладающий каталитическими свойствами. Этот рибозим обладает устойчивой структурой, имеет эндонуклеазную активность, расщепляя длинные одноцепочечные РНК, и проявляет специфичность, распознавая в о составе атакуемого субстрата тетрануклеотиды CUCU. В структуре интронов типа I выявлены характерные внутренние олигопуриновые последовательности (у тетрахимены это последовательность GGAGGG), называемые адапторными последовательностями, которые участвуют в образовании активного центра РНК-ферментов и выполняют важнейшую роль в каталитическом расщеплении РНК.
Такое самовырезание интронов характерно для пре-рРНК других простейших. Этот механизм, по-видимому, действует и при удалении интронов из первичных транскриптов иРНК и тРНК в митохондриях и хлоропластах, которые относятся к группе II.
Для вырезания интронов второй группы также необходимы две автокаталитические реакции, но гуанозин не требуется.
Дальнейшие исследования позволили установить, что каталитической активностью обладают не только крупные РНК (~400 нуклеотидов у тетрахимены и РНКазы Р), но и короткие 13 —20-членные олигонуклеотиды, которые могут быть синтезированы in vitro. Такие рибозимы стали называть минизимами. Одна из детально исследованных моделей функционирования таких рибозимов получила название «головка молотка» (рис. 146). Третичная структура «головки молотка» стабилизируется ионами двухвалентных металлов, которые нейтрализуют отрицательно заряженные атомы кислорода фосфодиэфирных связей и одновременно соединяют фосфатные группы ковалентными связями, что существенно для образования стабильного переходного состояния (фермент-субстратного комплекса). Как и в случае катализа, осуществляемого ферментами белковой природы, рибозимы и атакуемый субстрат
(природные или синтетически полученные молекулы РНК) образуют фермент-субстратный комплекс, а затем — фермент-продуктный комплекс (см. рис. 146).
Механизмы сплайсинга: сплайсосома. (Процессинг мРНК у эукариот)
В ядерных пре-мРНК интроны могут достигать в длину 20 000 нуклеотидов. Поэтому их удаление требует более сложного механизма, чем самовырезание (автоэксцизия). (рис.12-13). Нуклеотидные последовательности на концах интронов в этих молекулах сходны: на 5'-концах часто находится динуклеотид (GU) ГУ, а на З'-конце – динуклеотид (AG) АГ. C этими последовательностями связываются молекулы специальных белков, которые формируют комплекс, называемый сплайсомой. Основной компонент сплайсосом – малые ядерные рибонуклеопротеины, или мяРНП, которые найдены только в ядре и обогащены остатками уридина. Поэтому малые ядРНК часто обозначают U1, U2 …U6.
[Коничев, с.292. В сплайсинге пре-мРНК
у высших эукариот задействован ряд белков, а также РНК особого вида – малые ядерные РНК (мяРНК). Малые ядерные РНК имеют последовательности протяженностью от 65 до 1000 и более нуклеотидов (10S —90S), богатые уридиловыми нуклеотидами, и поэтому называются также uPHK (Ul, U2 и т.д.). У дрожжей выявлено 25 различных мяРНК, у позвоночных животных — 15. У шпорцевых лягушек Xenopus laevis ряд мяРНК (U3, U8, U14 и U22) участвуют в процессинге рибосомальных РНК, связываясь с пограничными участками спейсерных последовательностей (см. рис. 143). Малые ядерные РНК выявлены не только у позвоночных животных и дрожжей, но также у насекомых и архибактерий. Они представляют собой, вероятно, очень древнюю группу молекул. Нуклеотидная последовательность всех соответствующих uPHK
эукариот совпадает более чем на 90 %, что, в частности, относится к U1 человека и дрозофилы. Высокий консерватизм структуры uPHK говорит о том, что сплайсинг представляет собой очень древний процесс, начавшийся с аутосплайсинга (см. выше) и трансформировавшийся в сплайсинг с участием особых рибонуклеопротеидных частиц — мяРНП. Гены мяРНК транскрибируются РНК-полимеразой II и имеют различную локализацию в геноме: часть из них представляет собой дискретные независимые гены,
не имеющие интронов, тогда как гены других мяРНК располагаются внутри интронов генов, кодирующих белки. Так, у Xenopus U13 кодируется тремя уникальными последовательностями, находящимися
в интронах 5, 6 и 8 генов белков теплового шока, а ген U16 находится внутри интрона рибосомального белка L1. Последнее обстоятельство имеет важное значение, так как показывает, что процессинг рРНК и процессинг мРНК белков рибосом может быть скоординирован при участии мяРНК. Кроме того,
предполагают, что мяРНК способны служить РНК-шаперонами, участвуя в фолдингерРНК, т.е. помогая ей принять необходимую структуру в пространстве. Малые ядерные РНК присутствуют в ядрах в комплексах с белками, получившими название малыерибонуклеопротеиновые частицы (мяРНП). Стабильным компонентом мяРНП является белок фибрилларин — очень консервативный по структуре белок с молекулярной массой 34 кДа, локализованный в ядрышках. Комплекс, состоящий из множества мяРНП, который катализирует сплайсинг ядерных про-мРНК, носит название сплайсингосомы. ]
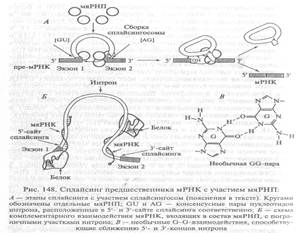
Известно, мяРНК типа U1, содержит нуклеотидную последовательность, гомологичную 5'-концу интрона. Спаривание этих последовательностей дает начало сплайсоме. Затем к ней присоединяется мяРНК типа U2, U4, U5 и U6 начинается сплайсинг. Как и в случае интронов первой группы происходит две реакции трансэтерификации. Сначала З'- гидроксильная группа аденина (А), локализованного в интроне, взаимодействует с 5'-сайтом сплайсинга, разрезая цепь РНК. Затем несколько мяРНП формируют промежуточный комплекс и начинается вторая реакция: свободный 5'-конец интрона соединяется с остатком аденина. В результате формируется характерная петлеобразная структура типа лассо, содержащая удаленный интрон. Затем концы экзонов лигируют и комплекс мяРНК освобождает транскрипт.
[ Коничев, с.294. Взаимодействие разных мяРНК, входящих в состав сплайсингосомы, со сплайсируемой пре-мРНК в 5'- и З'-сайтах сообщает интрону петлеобразную структуру. При этом сближаются концы экзонов, чему способствует образование неканонических (отличающихся от уотсон-криковских пар) водородных связей между двумя гуанинами, содержащимися в 5'- и З'-сайтах сплайсинга (см. рис. 148). Сближение экзонов создает условие для атаки З'-конца интрона адениловым нуклеотидом, расположенным вблизи З'-конца. В результате разрыва фосфодиэфирной связи между экзоном 1 и 5'-концом интрона последний взаимодействует с адениловым нуклеотидом и образованием в интроне петли типа «лассо» (см. рис. 148_Коничев). Вслед за этим освободившийся З'-ОН-конец экзона 1 разрезает З'-сайт сплайсинга, выщепляет интрон и, соединяясь с экзоном 2, образует в итоге зрелую (сплайсированную) молекулу мРНК ]
 2014-02-09
2014-02-09 7555
7555







