V. Текст лекции
IV. Учебно-материальное обеспечение
III. Литература
II. Расчет учебного времени
| Содержание и порядок проведения занятия | Время, мин |
| ВВОДНАЯ ЧАСТЬ ОСНОВНАЯ ЧАСТЬ Учебные вопросы 1. Типы взрывов, физические и химические взрывы. 2. Объем воздуха, необходимый для горения. 3. Объем и состав продуктов горения веществ и материалов. ЗАКЛЮЧИТЕЛЬНАЯ ЧАСТЬ |
основная
1. Корольченко А.Я. Процессы горения и взрыва. – М.: Пожнаука, 2007. – 266 с., ил.
дополнительная
1. Корольченко А.Я., Корольченко Д.А. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х ч. – 2-е изд., перераб. И доп. – М.: Асс. «Пожнаука», 2004.
2. Марков В.Ф., Маскаева Л.Н., Миронов М.П., Пазникова С.Н. Физико-химические основы развития и тушения пожаров: Учебное пособие для курсантов, студентов и слушателей образовательных учреждений МЧС России / Под ред. В.Ф.Маркова. Екатеринбург: УрО РАН. 2009. 274 с.
3. Расчетно-аналитические зависимости для решения задач по курсу «Теория горения и взрыва»: справочный материал / сост. Д.В. Батов, Т.А. Мочалова, А.В. Петров. – Иваново: ООНИ ИвИ ГПС МЧС России, 2008. – 35 с.
1. Технические средства обучения: мультимедийный проектор, компьютерная техника.
На предыдущей лекции мы изучили понятие взрыва.
Взрыв - физический или химический быстропротекающий процесс с выделением значительной энергии в небольшом объёме (по сравнению с количеством выделяющейся энергии), приводящий к ударным, вибрационным и тепловым воздействиям на окружающую среду и высокоскоростному расширению газов. При химическом взрыве, кроме газов, могут образовываться и твёрдые высокодисперсные частицы, взвесь которых называют продуктами взрыва. Взрывы классифицируют по происхождению выделившейся энергии на:
химические и физические.
| В З Р Ы В | ||||
| ß | ß | |||
| ХИМИЧЕСКИЙ ВЗРЫВ | ФИЗИЧЕСКИЙ ВЗРЫВ | |||
| ß | ß | ß | ß | ß |
| ВЗРЫВ КОНДЕНСИРОВАННЫХ Взрывчатых Веществ | ОБЪЁМНЫЙ ВЗРЫВ | ВЗРЫВ ЁМКОСТЕЙ С ГАЗОМ ПОД ДАВЛЕНИЕМ | ВЗРЫВ ЁМКОСТЕЙ С ПЕРЕГРЕТЫМИ ЖИДКОСТЯМИ | ВЗРЫВ ПРИ КОНТАКТЕ РАСПЛАВЛЕННЫХ МЕТАЛЛОВ С ВОДОЙ (без хим. взаимодействия |
К химическим взрывам относятся процессы химического превращения вещества, проявляющиеся горением и характеризующиеся выделением тепловой энергии за короткий промежуток времени и в таком объёме, что образуются волны давления, распространяющиеся от источника инициирования взрыва.
Источник инициирования взрыва – источник, обладающий запасом энергии или температуры, достаточным для инициирования взрыва взрывоопасной среды производственного процесса. (ГОСТ 12.1.010-76. Взрывобезопасность. Общие требования.)
Химический взрыв подразделяется на:
- взрывы конденсированных взрывчатых веществ;
- объёмныe взрывы.
К первой группе относятся взрывы: нитроглицерина, некоторых органических пероксидных соединений и ацетиленида меди. К объёмным взрывам относятся взрывы метано-, пропано-воздушных смесей, водородо-воздушных смесей.
Химические взрывы чаще всего происходят при хранении, транспортировке и изготовлении взрывчатых веществ; в химической и нефтехимической промышленности; при утечках природного газа в жилых помещениях.
К физическим взрывам относятся процессы, приводящие к взрыву и не связанные с химическим превращением вещества. Эти взрывы, связывают со взрывами сосудов от давления паров и газов. Причём, основной причиной их образования является физический процесс, обусловленный высвобождением внутренней энергии сжатого или сжиженного газа. Сила таких взрывов зависит от внутреннего давления.
Физический взрыв подразделяется на:
взрыв ёмкостей с газом или паром под давлением;
взрыв ёмкостей с перегретыми жидкостями;
взрыв при контакте расплавленных металлов и других веществ с водой.
Примером взрыва ёмкости с газом под давлением является падение переносного баллона с газом под давлением и срыва вентиля, понижающего давление.
Основными причинами взрывов ёмкостей являются:
- нарушение целостности корпуса из-за поломки, или коррозии при непрерывной эксплуатации;
- перегрев сосуда за счёт нарушений в электрообогреве;
- взрыв паровых котлов при превышении допустимого давления.
При взрыве ёмкости с перегретой жидкостью, через повреждения в аппарате происходит испарение пара в окружающее пространство и быстрое частичное испарение жидкости, при этом в окружающей среде генерируются взрывные волны.
Примером взрывов при контакте расплавленных металлов с водой является взаимодействие расплавленного алюминия с водой при аварии на атомном реакторе, контакте с ней расплавленной стали в литейном цехе или расплава солей (Na2CO3, Na2S) в бумажной промышленности.
Вывод по вопросу: к взрыву может привести как бурно протекающие химические реакции, так и физические процессы
Вопрос 2. Объем воздуха, необходимый для горения
При возникновении пожара, чаще всего, в качестве окислителя выступает кислород воздуха. В состав воздуха входит: азот – 78,2 % (об.), кислород – 20,9 % (об.), инертные газы – 0,9 % (об.). В теоретических расчётах процентное содержание инертных газов суммируют с содержанием азота и принимают, что воздух состоит из 21 %(об.) кислорода и 79 % (об.) азота. Следовательно, на 1 объём кислорода приходится 3,76 объёма азота (79:21 = 3,76). Так как равные объёмы газов содержат одинаковое количество молекул, то в воздухе на 1 моль кислорода приходится 3,76 моль азота.
Горючесть и коэффициент горючести веществ
По способности гореть вещества и материалы классифицируют на негорючие, трудногорючие, горючие.
Негорючие – вещества и материалы, не способные к горению в воздухе.
Трудногорючие – вещества и материалы, способные к горению в воздухе при воздействии источника зажигания, но не способные самостоятельно гореть после его удаления.
Горючие – вещества и материалы, способные самовозгораться, а также возгораться при воздействии источника зажигания и самостоятельно гореть после его удаления.
Горючесть вещества оценивается по коэффициенту горючести, обозначаемому буквой К, который рассчитывается по формуле:
К = 4nC + 4nS + nH + nN - 2nO - 2nCl - 3nF - 5nBr
где: nC, nS, nH, nN, nO, nCl, nF, nBr- соответственно число атомов углерода, серы, водорода, азота, кислорода, хлора, фтора, брома в молекуле вещества.
Если расчётное значение К £ 0 – вещество негорючее, 0 < К £ 2 – вещество трудногорючее, К > 2 – вещество является горючим.
Методика расчёта материального баланса процесса горения зависит от состава вещества и его агрегатного состояния. По составу вещества делятся на простые и сложные; по агрегатному состоянию - на твёрдые, жидкие и газообразные.
Простым веществом называется вещество, состоящее из атомов одного элемента. Примерами таких веществ являются Na, N2, O2, Сl2.
Сложные вещества подразделяются на вещества постоянного состава (дальтониды) и вещества переменного состава (бертоллиды). В химической литературе сложные вещества постоянного состава, названы индивидуальными химическими соединениями, а сложные вещества переменного состава – сложной смесью химических соединений.
Вещества постоянного состава можно описать одной химической формулой (например, C2H6 – этан, COS – оксид сероуглерода), вещества переменного состава – нельзя. Поэтому расчёт основан на заданных массовых долях элементов: углерода, водорода, кислорода и т.д., выраженных в процентах. К таким веществам относится каменный уголь, нефть, древесина.
Избыток воздуха. На пожаре расходуется значительно больше воздуха по сравнению с теоретически необходимым количеством, которое определяется по уравнению реакции горения. Отношение объёма воздуха, практически расходуемого на горение (VВ), к объему, теоретически необходимому (V0в) для горения, называется коэффициентом избытка воздуха и обозначается греческой буквой a.
Коэффициент избытка воздуха показывает во сколько раз больше поступает в зону горения воздуха, чем теоретически необходимо для полного сгорания вещества.
a = VB/V0B
Следовательно, объем избытка воздуха можно рассчитать:
VВ,ИЗБ = a V0B - V0B = V0B (a - 1), м3
При горении с естественным притоком воздуха коэффициент избытка воздуха практически всегда превышает единицу и колеблется в пределах от 2 до 20. Если в задаче не задаётся коэффициент избытка воздуха, температура и давление, то расчёт проводится при стандартных условиях и .a = 1.
Стандартные условия Т = 298 К (t = 25 оС), Р = 101325 Па (р = 760 мм.рт.ст.).
Нормальные условия: Т = 273 К (t = 0 оС), Р = 101325 Па (р = 760 мм.рт.ст.).
Методика расчёта объёма воздуха для горения простых веществ и
индивидуальных химических соединений
в твёрдом и жидком агрегатном состоянии
(расчет по массе)
Расчёт объема воздуха, необходимого для полного сгорания заданного в килограммах количества вещества, находящегося в твёрдом или жидком агрегатном состоянии, проводят по формуле:
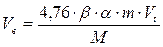 , м3
, м3
где:
b - стехиометрический коэффициент перед кислородом;
m - масса горючего вещества, кг;
a - коэффициент избытка воздуха;
M - молярная масса горючего вещества, кг/кмоль.
Vt- мольный объём газа при заданных условиях, м3/кмоль;
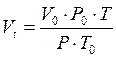 , м3/кмоль
, м3/кмоль
где:
V0 – объем газа при н.у. = 22,4 м3/кмоль,
Т - заданная температура, К;
Р - заданное давление, Па;
Ро - давление при нормальных условиях = 101325 Па,
То - температура при нормальных условиях = 273 К.
Методика расчёта объёма воздуха для горения простых веществ и
индивидуальных химических соединений в газообразном состоянии
(расчет по объему)
Расчёт объема воздуха, необходимого для полного сгорания заданного в кубических метрах объёма вещества, находящегося в газообразном агрегатном состоянии, проводят по формуле:
VВ = 4,76 × b × a × VГГ, м3
где:
b - стехиометрический коэффициент перед кислородом;
a - коэффициент избытка воздуха;
VГГ - заданный объём горючего газа, м3.
Вывод по вопросу: установлено, что для полного сгорания веществ требуется определенное количество воздуха, объем которого зависит от состава вещества и его агрегатного состояния. Рассмотрены методики расчёта объёма воздуха необходимого для сгорания простых веществ и индивидуальных химических соединений в твёрдом (жидком) и газообразном состоянии.
 2014-02-09
2014-02-09 10246
10246








