Практически несмешивающиеся жидкости
Ограниченная растворимость
Неограниченная растворимость
(вода — этанол),
(вода — фенол),
(вода — бензол).
Растворимость жидкости в жидкости обычно увеличивается с повышением температуры и практически не зависит от давления. В случае ограниченно растворимых жидкостей существует критическая температура после которой происходит полная взаимная растворимость. Например, для системы вода – анилин верхняя критическая температура равна 168 оС.
4.4 Экстракция
В случае несмешивающихся жидкостей при внесении третьего компонента, растворимого в обоих жидкостях, происходит распределение его между двумя жидкостями в определенном соотношении концентраций (закон распределения)
К = С1/С2 (3.7)
где С1 и С2 концентрация третьего компонента соответственно в первом и втором растворителях,
Данное явление широко используется на практике и называется экстрагирование (извлечение). Например, константа распределения йода между хлороформом и водой равна 130, то есть после установления равновесия концентрация йода в хлороформе будет в 130 раз выше чем в воде. Если заменить слой хлороформа на чистый хлороформ, то распределение обратно станет равным 130 и после третьего экстрагирования концентрация йода в воде станет практически равной нулю.
|
|
|
ЛЕКЦИЯ № 4
«РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ»
1 Свойства растворов неэлектролитов
Неэлектролиты – это вещества, растворы которых не проводят электрический ток. В растворенном состоянии они сохраняют молекулярную структуру. Как правило, это органические соединения (спирт, глюкоза, и т.д.).
Важной характеристикой раствора является давление паров растворителя и растворенного вещества над раствором, так как плавление, кипение и другие процессы, приводящие к фазовым переходам, протекают при определенных значениях давлений паров над раствором.
Далее мы рассмотрим влияние концентрации растворенного вещества на изменение давления пара над раствором и соответственно на изменение температур кипения и замерзания растворов, а также осмотического давления.
1.1 Закон Рауля
Рассмотрим двухкомпонентный раствор:
1) растворитель – летучее вещество,
2) растворенное вещество – нелетучее и не диссоциирующее на ионы.
Летучие вещества – это вещества которые можно перевести в газообразное состояние при атмосферном давлении.
Количественно равновесное состояние между жидкостью и паром характеризуется давлением насыщенного пара. Обозначим:
р0 – давление насыщенного пара над чистым растворителем,
р – давление насыщенного пара над раствором.
Молекулы нелетучего компонента препятствуют улетучиванию из раствора молекул растворителя (какая-то часть поверхности просто занята ими), т.е. р0 > р. Таким образом, давление насыщенного пара растворителя над раствором ниже, чем над чистым растворителем. Разность между этими величинами
|
|
|
(р0 - р) – абсолютное значение понижения давления пара растворителя над раствором. Если эту величину разделить на значение давления пара чистого растворителя, то получим
( 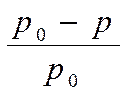 ) – относительное понижение давления пара растворителя над раствором.
) – относительное понижение давления пара растворителя над раствором.
В 1887г французский ученый Ф.М. Рауль открыл закон, согласно которому относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества. Математически закон Рауля выражается уравнением
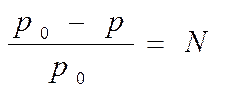 . (4.1)
. (4.1)
Из закона Рауля следует, что понижение давления пара над раствором не зависит от природы растворенного вещества, а только от количества частиц растворенного вещества.
Уменьшение давления пара над раствором приводит соответственно к повышению температуры кипения и понижению температуры замерзания раствора.
1.2 Криоскопический и эбуллиоскопический законы Рауля
Данные законы позволяют рассчитывать повышение температуры кипения, понижение температуры замерзания растворов нелетучих неэлектролитов.
Температура кипения – это температура при которой давление пара над раствором становится равным внешнему давлению. Для достижения раствором данного давления пара растворителя требуется более высокая температура в сравнении с чистым растворителем.
Температура замерзания – это температура при которой давление пара над раствором станет равным давлению насыщенного пара над кристаллами растворителя. Для раствора, в сравнение с чистым растворителем, температура замерзания ниже.
В практических расчетах удобно пользоваться криоскопическим и эбуллиоскопическим законами Рауля:
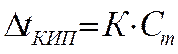 - криоскопический закон, (4.2)
- криоскопический закон, (4.2)
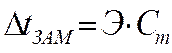 - эбуллиоскопический закон, (4.3)
- эбуллиоскопический закон, (4.3)
где 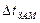 – понижение температуры замерзания,
– понижение температуры замерзания,
К – криоскопическая постоянная растворителя,
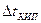 – повышение температуры кипения,
– повышение температуры кипения,
Э – эбулиоскопическая постоянная растворителя,
Сm — моляльная концентрация растворенного вещества.
Значения криоскопических и эбулиоскопических констант для воды и бензола приведены в таблице 4.1.
Таблица 4.1 – Криоскопические и эбулиоскопические константы воды и бензола
| Раствори- тель | tКИП, °С | КЭ, град·моль-1·кг | tЗАМ, °С | ККР, град·моль-1·кг |
| Вода – Н2О Бензол – С6Н6 | 80,1 | 0,52 2,53 | 5,5 | 1,86 5,12 |
Физический смысл криоскопических и эбулиоскопических постоянных следующий. Они показывают, на сколько градусов выше кипит и на сколько градусов ниже замерзает одномоляльный раствор (содержащий I моль растворенного вещества на 1кг растворителя) по сравнению с температурами кипения и замерзания чистого растворителя.
Криоскопические и эбуллиоскопические константы не зависят от природы растворенного вещества, а являются характеристиками растворителя.
Способность растворов замерзать при более низкой температуре, чем растворитель, используется при приготовлении низкозамерзающих водных растворов, которые называются антифризами. В качестве основных компонентов могут быть использованы многоатомные спирты – этиленгликоль или глицерин.
Например, водный раствор этиленгликоля (58 %-ный по массе) замерзает при температуре -50 °С.
2 Осмос
Осмос – переход растворителя из менее концентрированного раствора в более концентрированный раствор.
Осмос обусловлен диффузией молекул растворителя через полупроницаемую перегородку, которая пропускает только молекулы растворителя. Молекулы растворителя диффундируют из растворителя в раствор или из менее концентрированного раствора в более концентрированный, поэтому концентрированный раствор разбавляется, что приводит к увеличению высоты столба жидкости на величину h (рисунок 4.1).
|
|
|
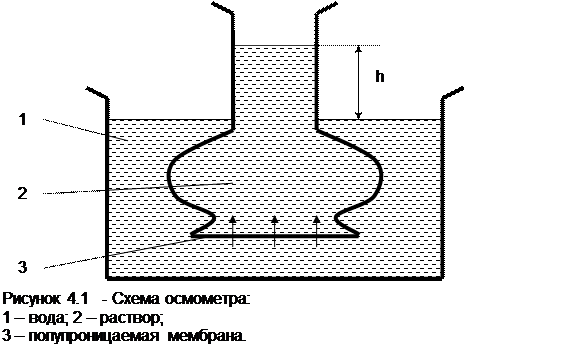 Осмос прекращается когда внешнее давление уравновешивает осмотическое давление.
Осмос прекращается когда внешнее давление уравновешивает осмотическое давление.
Если создать внешнее давление выше осмотического, то растворитель из более концентрированного раствора будет переходить в разбавленный раствор (или чистый растворитель). Этот процесс называется обратным осмосом. Он используется для очистки природных и сточных вод, для получения питьевой воды из морской.
 2014-02-09
2014-02-09 1505
1505








