Измерение (определение), обработка данных, выводы и отчет.
Разделение и концентрирование.
1.4.1. Экстракция.
Экстракция — это процесс переноса растворенного вещества из одной жидкой фазы в другую, не смешивающуюся с ней, из водного раствора в слой не смешивающегося с водой органического разбавителя. Экстракция представляет собой один из методов фазового разделения веществ и широко применяется при пробоподговке в физико-химических методах исследования. Причины популярности экстракционных методов заключаются в следующем. Одной из важных задач анализа является необходимость определения микроколичеств элементов. Нередко эти количества находятся ниже предела обнаружения методов, используемых для определения. Поэтому перед заключительным определением проводят концентрирование.
В экстракционном концентрировании повышение концентрации связано с переходом вещества из большого объема водного раствора в очень небольшой объем органического разбавителя. Кроме так называемого абсолютного концентрирования, т. е. простого увеличения концентрации вещества, при экстракции достигается также относительное концентрирование, под которым понимают изменение соотношения концентраций определяемого и мешающего компонентов (изменение соотношения микро- и макрокомпонента). Причина состоит в том, что при некоторых заранее подобранных условиях микрокомпонент переходит в органическую фазу в значительно большей степени, чем макрокомпонент. Относительное концентрирование повышает специфичность определения микрокомпонента, Макрокомпонент, который до экстракции содержался в водном растворе в очень большой концентрации, препятствующей определению микрокомпонента, после извлечения находится в органической фазе в таком отношении к микрокомпоненту, что не мешает его определению,
|
|
|
Широкое развитие экстракционных методов объясняется также большой эффективностью экстракции как способа разделения основных компонентов анализируемого материала.
Другие существенные преимущества экстракции — ее универсальность, простота и экспрессносгь. Универсальность характеризуется тем. что для любых элементов всегда можно подобрать такие условия и такие реагенты), посредством которых можно отделить один элемент (или несколько) от другого (или других). Разделение достигается очень простыми средствами. Достаточно иметь делительную воронку с хорошо пришлифованным стеклянным краном. Переход вещества и органическую фазу обычно происходит очень быстро — за 3—5 мин, достаточно несколько раз перевернуть воронку с содержимым — с водным раствором и органическим разбавителем, и разделение можно считать законченным.
|
|
|
При экстракции обычно не все вещество переходит в органическую фазу — некоторая его часть остается в водном растворе и через некоторое время в такой системе установится равновесие
АВ ⇄ АО
где АВ и АО — вещество А в воде и в органическом растворителе соответственно.
Процесс переноса растворенного вещества из одной жидкой фазы в другую, с ней несмешивающуюся или ограниченно смешивающуюся жидкую фазу, называют жидкость-жидкостным распределением или распределением между двумя жидкостями. Количественно этот процесс характеризуется законом распределения Нернста—Шилова, в соответствии с которым отношение концентраций растворенного вещества в обеих фазах при постоянной температуре постоянно и не зависит от общей концентрации растворенного вещества:
D = 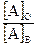
где D — коэффициент распределения; [А]O — аналитическая, т. е. суммарная концентрация всех форм вещества А в органической фазе; [А]B — то же, в водной фазе.
Коэффициент распределения D не является постоянной величиной. Величина D сохраняет постоянство лишь в отсутствие процессов диссоциации, ассоциации, полимеризации и других превращений растворенного вещества.
Очень часто в практике пользуются степенью экстракции (фактор извлечения). Степень экстракции R — это отношение количества вещества в органической фазе (n A)oк его общему количеству n A в обеих фазах при некоторых данных условиях. Степень экстракции обычно выражают в процентах:
R = 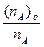
Для количественного разделения обычно достаточно, если степень экстракции составляет 99 или 99,9%, т. е. если некоторая небольшая часть вещества остается в водном растворе. Это бывает не всегда: нередко степень экстракции составляет 90 % или меньше. Однако и в этом случае можно добиться практически полного извлечения, применив двух- или трехкратную экстракцию новыми порциями раствора реагента в органическом разбавителе.
Очень часто для характеристики процесса экстракции пользуются константой экстракции. Константа экстракции — это константа равновесия реакции распределения. Константу экстракции используют для расчетов. Зная значения констант экстракции для разных элементов, можно найти условия количественного разделения двух элементов.
Степень экстракции, коэффициент распределения, константы экстракции, константы распределения зависят, естественно, от характера соединения, в виде которого его извлекают, а также от типа органического разбавителя. Для экстракции применяют органические разбавители, которые практически не смешиваются с водой или взаимная растворимость которых (разбавителя в воде и воды в разбавителе) очень ограничена. Органические разбавители часто реагируют с экстрагирующими соединениями, образуя с ними более или менее устойчивые соединения — сольваты. Образование сольватов облегчает процесс экстракции и приводит к более полному переходу вещества в органическую фазу. Различают инертные и активные разбавители. Инертные разбавители или совсем не сольватируют экстрагирующееся соединение, или их способность к сольватации выражена очень слабо. Способность к сольватации часто обусловлена образованием водородных связей между атомами кислорода разбавителя и атомами водорода экстрагирующегося соединения.
В практическом отношении важное значение имеет плотность разбавителя. По этому признаку различают две группы разбавителей: легкие и тяжелые. К тяжелым разбавителям относят тетрахлорид углерода СС14, хлороформ СНС13, плотность которых равна соответственно 1,59 и 1,49, и др. К легким разбавителям относят бензол, диэтиловый эфир, изоамиловый спирт (СН3)2СН(СН2)ОН, плотность которых равна соответственно 0,88; 0,71; 0,81.
|
|
|
Для экстракции удобнее применять тяжелые разбавители. Они находятся под слоем водного раствора, и поэтому экстракт легко отделить от водного раствора, что представляет определенное преимущество при повторных экстракциях. Тяжелые разбавители, находящиеся под слоем водного раствора, меньше испаряются и не отравляют атмосферу своими парами.
Многие органические разбавители токсичны; поэтому при экстракции необходимо соблюдать меры предосторожности. Следует также иметь в виду огнеопасность многих разбавителей. Так, диэтиловый эфир очень легко воспламеняется, при работе с ним нельзя применять для нагревания электрические плитки или газовые горелки.
С помощью экстракционных методик проводят разделение элементов, относительное концентрирование примесей и очистку основного компонента от примесей. Экстракция – распространенный метод пробоподготовки перед проведением измерений методами полярографии, эмиссионной спектроскопии, атомно-абсорбционной спектрометрии и др.
Экстракция является весьма эффективным методом разделения и концентрирования, особенно при отделении микрокомпонента смеси от больших количеств других веществ. Существенным достоинством экстракционных методов является их быстрота. Для проведения разделения обычно бывает достаточно нескольких минут и, как правило, кроме делительной воронки никакой другой аппаратуры не требуется. Широкий выбор экстракционных реагентов и растворителей позволяет подобрать оптимальные условия селективного выделения того или иного компонента практически из любой смеси. Нередко экстрагированное соединение окрашено, что позволяет непосредственно использовать экстракт для количественных фотометрических определений микрокомпонента. Крупные успехи в анализе микрокомпонентов достигнуты в значительной степени благодаря применению экстракционных методик, которые продолжают интенсивно развиваться и совершенствоваться.
|
|
|
1.4.2. Ионный обмен.
Твердые ионообменники — это макромолекулы нитевидного или каркасного строения, содержащие ионогенные группы. Ионообменник представляет собой полиэлектролит с каналами и порами, в которые может проникать вода. Поэтому ионообменник способен к набуханию. Для осуществления разделения м концентрирования чаще всего используют органические ионообменики. Основу (матрицу) таких ионообменников составляет органический полимер, например сополимер стирола, дивинилбензола. Полиэлектролитные свойства обеспечиваются наличием привитых катионо- или анионообменных групп. Среди них наиболее распространены:
· катионообменные группы: -SО3Н, -СООН, -ОН, -РО(ОН)2
· анионообменные группы: -N+(СН3)3, -N+R3
· амфотерные группы: -N(CH2-COOH)2, HO3S-(матрица)-N+(CH3)3
Так же, как и низкомолекулярные кислоты и основания, ионогенные группы ионообменников можно классифицировать с точки зрения силы их кислотных или основных свойств. В связи с этим выделяют сильно- и слабокислотные катионообменники и сильно- и слабоосновные анионообменники. Для разделения ионов металлов предложены также ионообменники с привитыми группами, обладающими комплексообразующей способностью.
Способность ионообменника к поглощению определенного количества ионов характеризуют понятием емкость. Обычно ее выражают в виде удельной емкости — количества молей эквивалентов поглощаемых ионов, отнесенных к единице массы воздушно-сухого ионообменника. Удельная емкость большинства ионообменников находится в пределах 4-5 ммоль/г. Емкость сильнокислотных и сильноосновных ионообменников не зависит от рН. Для слабокислотных или слабоосновных ионообменников такая зависимость наблюдается.
Ионный обмен применяют для разделения катионов и анионов перед их определением и для концентрирования следовых количеств ионов.
1.4.3. Хроматография.
Этот метод разделения веществ подробно изложен в соответствующей лекции данной модульной дисциплины.
1.5.1. Измерение (определение).
В основе большинства физико-химических методов исследования лежит сравнение сигнала образца с сигналами одного или нескольких образцов сравнения точно известного состава; таким образом, необходимой частью методики является градуировка. Показания измерительных приборов подвержены нежелательным, но неизбежным флуктуациям, называемым шумом. Уровень шума обычно характеризуют стандартным отклонением флуктуации сигнала. Для улучшения качества результатов необходимо увеличение отношения сигнал/шум. Это можно обеспечить как на стадии измерения, так и на стадии обработки данных.
1.5.2. Обработка данных.
В настоящее время большинство аналитических приборов снабжено компьютерами. В результате операция преобразования данных в аналитическую форму (концентрации компонентов или их структурные параметры) стала неотъемлемой составной частью аналитической системы. Она осуществляется автоматически — аналитику нет нужды обрабатывать и даже вообще контролировать первичные данные. Поэтому очень важное значение имеет правильная работа используемого программного обеспечения.
Таким образом, в настоящее время решающими факторами успеха в химическом анализе являются проверкикак самой методики, так и программного обеспечения.
Во многих случаях, например, при идентификации веществ методами распознавания образов, анализ вообще невозможен без помощи компьютеров. Исходным материалом для построения образов могут служить, в частности, данные инфракрасных или масс-спектров. Процедуры, основанные на сравнении спектра неизвестного соединения со спектрами индивидуальных веществ, хранящихся в памяти компьютера, называются поиском в базах данных или библиотечным поиском.
1.5.3. Выводы и отчет
Аналитик несет полную ответственность за результаты, которые собирается сообщить. Он должен четко указать, с какой точностью получены все данные, избежать любой возможной двусмысленности в их интерпретации. Для обеспечения качества результатов необходимо проверять применяемые методики на аттестованных стандартных образцах (материалах известного состава, проанализированных различными методами в различных лабораториях). Если стандартные образцы недоступны, можно сравнить полученные результаты с данными, полученными с помощью независимой методики (желательно, аттестованной арбитражной методики). Аналитик должен быть уверенным в том, что полученные им данные действительно необходимы для решения общей задачи, поставленной заказчиком.
Аналитик несет ответственность не только за результаты анализа как таковые, но и за все последующие заключения, которые могут быть полученные на основе этих результатов. В отчете следует четко указать, какова точность полученных данных. Должна быть исключена любая возможность, позволяющая заказчику прийти к необоснованным выводам.
Вопросы для повторения:
1. В чем заключаются сходства и различия физико-химических методов исследования и физико-химических методов анализа?
2. Каковы задачи элементного, вещественного и структурного анализа?
3. Какие современные физико-химические методы анализа позволяют осуществить исследование элементного состава объекта?
4. Можно ли в настоящее время провести четкую границу между качественным и количественным анализом?
5. Какие задачи стоят перед валовым и локальным анализом?
6. Каковы основные этапы процесса физико-химического исследования?
7. Чем различаются методика анализа, метод анализа и принцип анализа?
8. В чем заключаются задачи пробоотбора?
9. Какие требования предъявляются к пробе?
10. Какие физические методы пробоподготовки Вам известны?
11. Каковы важнейшие методы пробоподготовки?
12. С какой целью в пробоподготовке используют экстракцию?
13. Какие преимущества имеет экстракция как метод пробоподготовки?
14. Что такое коэффициент распределения?
15. Что такое степень экстракции?
16. С какими целями в пробоподготовке применяют ионный обмен?
Знание классификация методов физико-химического исследования позволяет осуществить выбор оптимального метода. Правильные пробоотбор и пробоподготовка служат надежным фундаментом дальнейших исследований. Важную роль в исследовании играют его завершающие этапы: обработка и представление данных (составление отчета).
Тестовые задания к лекции 1
1. Полное описание всего хода анализа – это …
а) методика анализа (верно);
б) метод анализа;
в) принцип анализа;
г) аналитическая задача.
2. Если необходимо определить, из каких химических элементов состоит объект, то речь идет о ….
а) вещественном анализе;
б) структурном анализе;
в) элементном анализе (верно);
г) количественном анализе.
3. Правильная последовательность этапов анализа приведена в пункте:
а) пробоотбор – измерение – пробоподготовка – обработка результатов;
б) пробоотбор – пробоподготовка – измерение– обработка результатов (верно);
в) пробоподготовка – пробоотбор – измерение –обработка результатов;
г) пробоотбор – измерение – обработка результатов – пробоподготовка.
4. Операцию уравновешивания необходимо проводить при отборе проб жидкостей и газов для предотвращения потерь, связанных с …
а) адсорбцией на внутренней поверхности стенок сосуда (верно);
б) испарением летучих соединений в процессе хранения;
в) окисления компонентов образца кислородом воздуха;
г) разложением компонентов образца под действием света.
5. Процесс, в результате которого возрастает концентрация компонента в растворе либо его доля по отношению к матрице по сравнению с исходной пробой называется:
а) разбавлением;
б) разделением;
в) концентрированием (верно);
г) выделением.
6. К пробе не предъявляется следующее требование:
а) проба должна быть представительной по отношению к объекту анализа;
б) проба не должна содержать посторонних примесей;
в) проба должна быть устойчивой;
г) масса пробы не зависит от степени ее однородности (верно).
7. При отборе проб газов, поглощаемых жидкостями, используют устройство, изображенное на рисунке:

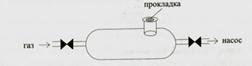
а) б) в) (верно) г)
8. Количественно процесс экстракции характеризуется законом:
а) Нернста-Шилова (верно);
б) Больцмана;
в) Фарадея;
г) Бугера-Ламберта-Бера.
9. Отношение количества вещества в органической фазе к его общему количеству в обеих фазах называется:
а) коэффициент распределения;
б) степень экстракции (верно);
в) константа экстракции;
г) константа распределения.
10. Катионообменной группой является:
а) -N+(СН3)3
б) -N(CH2-COOH)2
в) -N+R3
г) -SО3Н (верно).
 2014-02-09
2014-02-09 1372
1372







