Реакции в нейтральной среде
3K2SIVO3 + 2KMnVIIO4 + H2O ® 3K2SVIO4 +2MnIVO2¯ + 2KOH
электронный баланс
| SIV – 2ē ® SVI | |
| MnVII + 3ē ® MnIV |
метод полуреакций:
| MnO41- + 2H2O + 3ē ® MnO2 + 4OH- | |
| SO32- + 2OH- - 2ē ® SO42- + H2O |
––––––––––––––––––––––––––––––––––––––––––
2MnO4- + 4H2O + 3SO32- + 6OH- ® 2MnO2 + 8OH- + 3SO42- + 3H2O
или 2MnO4- + H2O + 3SO32- ® 2MnO2 + 2OH- + 3SO42-
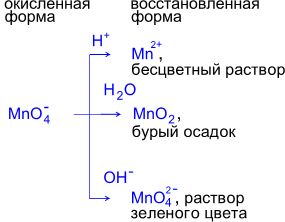
Фиолетовый раствор KMnO4 после окончания реакции обесцвечивается и наблюдается выпадение бурого осадка.
K2SIVO3 + 2KMnVIIO4 + 2KOH ® K2SVIO4 +2K2MnVIO4 + H2O
электронный баланс
| SIV – 2ē ® SVI | |
| MnVII + 1ē ® MnVI |
метод полуреакций:
| SO32- + 2OH- - 2ē ® SO42- + H2O | |
| MnO41- + ē ® MnO42- |
–––––––––––––––––––––––––––––––––––––
SO32- + 2OH- + 2MnO4- ® SO42- + H2O + 2MnO42-
Фиолетовый раствор KMnO4 превращается в зеленоватый раствор K2MnO4.
Таким образом,
Реакции с дихроматом калия в качестве окислителя
Степень окисления хрома понижается с VI до III. Наблюдается изменение окраски реакционной массы с желто-оранжевого цвета до зеленого или фиолетового.
1)
K2Cr2VIO7 + 3H2S-II + 4H2SO4 ® K2SO4 + Cr2III(SO4)3 + 3S0¯ + 7H2O
|
|
|
электронный баланс:
| 2CrVI + 6ē ® 2CrIII | |
| S-II - 2ē ® S0 |
метод полуреакций:
| Cr2O72- + 14H+ + 6ē ® 2Cr3+ + 7H2O | |
| H2S0 - 2ē ® S0 + 2H+ |
––––––––––––––––––––––––––––––––––
Cr2O72- + 8H+ + 3H2S ® 2Cr3+ + 7H2O + 3S0
2)
K2Cr2VIO7 + 6FeIISO4 + 7H2SO4 ® 3Fe2III(SO4)3 + K2SO4 + Cr2III(SO4)3 + 7H2O
электронный баланс:
| 2CrVI + 6ē ® 2CrIII | |
| FeII – ē ® FeIII |
метод полуреакций:
| Cr2O72- + 14H+ + 6ē ® 2Cr3+ + 7H2O | |
| Fe2+ - ē ® Fe3+ |
–––––––––––––––––––––––––––––––––––––
6Fe2+ + Cr2O72- + 14H+ ® 2Cr3+ + 6Fe3+ + 7H2O
3)
K2Cr2VIO7 + 14HCl-I ® 3Cl20 + 2KCl + 2CrIIICl3 + 7H2O
электронный баланс:
| 2CrVI + 6ē ® 2CrIII | |
| 2Cl-I – 2ē ® Cl20 |
метод полуреакций:
| Cr2O72- + 14H+ + 6ē ® 2Cr3+ + 7H2O | |
| 2Cl1- - 2ē ® Cl20 |
–––––––––––––––––––––––––––––––––––
Cr2O72- + 6Cl- + 14H+ ® 2Cr3+ + 3Cl20 + 7H2O
Пероксид водорода в окислительно-восстановительных реакциях
1. Обычно пероксид водорода используют как окислитель:
H2O2 + 2HI-I ® I20 + 2H2O
электронный баланс:
| 2I- - 2ē ® I20 | |
| [O2]2- + 2ē ® 2O2- |
метод полуреакций:
| 2I- - 2ē ® I20 | |
| H2O2 + 2H+ + 2ē ® 2H2O |
––––––––––––––––––––––
2I- + H2O2 + 2H+ ® I2 + 2H2O
2. При действии сильных окислителей пероксид водорода может окисляться, образуя кислород и воду.
5H2O2 + 2KMnVIIO4 + 3H2SO4 ® 5O20 + K2SO4 + 2MnIISO4 + 8H2O
электронный баланс:
| [O2]2- - 2ē ® O20 | |
| MnVII + 5ē ® MnII |
метод полуреакций:
| MnO4- + 8H+ + 5ē ® Mn2+ + 4H2O | |
| H2O2 - 2ē ® O2 + 2H+ |
––––––––––––––––––––––––––––––––––––––––––
2MnO4- +5H2O2 +16H+ ® 2Mn2+ +8H2O +5O2 +10H+
или 2MnO4- + 5H2O2 + 6H+ ® 2Mn2+ + 8H2O + 5O2
В ходе окислительно-восстановительной реакции происходит переход электронов от одного элемента к другому – соответственно различают
окисление (присоединение электронов) и восстановление (отдача электронов).
|
|
|
Вещество (или ион), атомы которого отдают электрон(ы), называется восстановителем, само вещество при этом окисляется (его степень окисления возрастает).
Вещество (или ион), которое присоединяет электроны, называется окислителем, само вещество при этом восстанавливается, (его степень окисления понижается).
2 Zn(тв) + O2 (г) ® 2 ZnO(тв)
0 II
2 Zn – 2×2 e– ® 2 Zn2+
восстановитель окисляется
0 -II
O2 + 4e– ® 2 O2–
окислитель восстанавливается
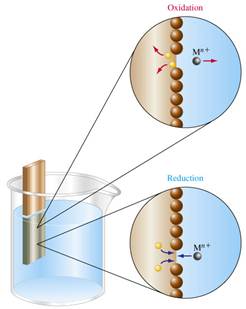 Если металлический стержень (электрод) поместить в раствор, содержащий ионы данного металла (например, медную проволоку в раствор сульфата меди), то между поверхностью металла и раствором возникнет электрический потенциал.
Если металлический стержень (электрод) поместить в раствор, содержащий ионы данного металла (например, медную проволоку в раствор сульфата меди), то между поверхностью металла и раствором возникнет электрический потенциал.
Величина потенциала зависит от свойств металла, концентрации его ионов в растворе и температуры раствора.
Так как этот потенциал трудно измерить «абсолютно», то пользуются сравнением с каким-либо определенным электродом.
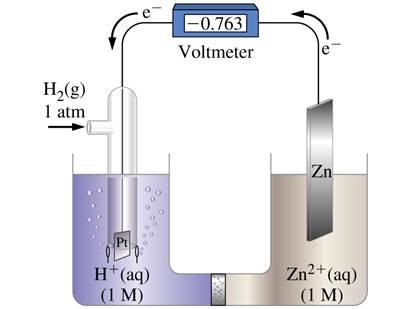
В качестве электрода сравнения выбран стандартный водородный электрод, потенциал которого по соглашению принимается равным нулю.
Потенциалы других электродов, измеренные относительно водородного электрода в стандартном состоянии называют стандартными окислительно-восстановительными потенциалами (E0 или e0, В) или стандартными потенциалами.
Стандартные условия: 25 °C (298,15 K)
Электролит – раствор 1 M HCl (H+, 1 M)
Давление водорода 1 атм
Концентрация ионов Men+ составляет 1 M
Платина не участвует в реакции, необходима лишь для обеспечения контакта (т.н. инертный электрод)
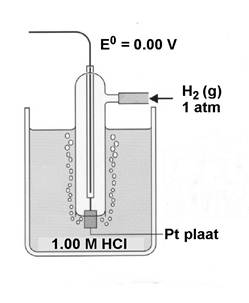
H2(г) – 2e– ® 2H+(aq) как анод (–) полюс
окисление
H+(aq) + 2e– ® H2(г) как катод (+) полюс
восстановление
Значения стандартных электродных потенциалов можно найти из соответствующих таблиц.
Например:

Металлические электроды, поставленные по мере возрастания значений стандартных потенциалов, образуют
ряд напряжений металлов:
 2014-02-09
2014-02-09 1280
1280








