Известно, что в зависимости от условий проведения, рассматриваемые химические взаимодействия могут протекать как в сторону образования продукта, так и в сторону образования исходных веществ.
Если скорость образования продукта численно равна скорости образования исходных веществ, то рассматриваемая система находится в состоянии равновесия.
Состояние равновесия характеризуется следующими свойствами:
1. неизменность состояния равновесия при постоянстве внешних усилий.
2. подвижность равновесия. Принцип Ле Шателье Брауна: если систему, находящуюся в равновесии подвергнуть какому–либо внешнему воздействию, то система будет компенсировать это внешнее воздействие. На основании принципа можно спрогнозировать смешение равновесия для единичной реакции.
Если реакция экзотермическая, то при увеличении температуры равновесие смещается в сторону исходных веществ.
Если эндотермическая, то при увеличении температуры равновесие смещается в сторону продуктов реакции.
Если реакция протекает с уменьшением объема газообразных реагентов, то при увеличении давления равновесие смещается в сторону продуктов реакции.
Если реакция идет с увеличением объема газообразных реагентов, то при увеличении давления равновесие смещается в сторону исходных веществ.
Если реакция идет без изменения объема газообразных реагентов, то изменение давления не влияет на изменение состояние равновесия.
Введение в реакционную смесь дополнительного количества исходных реагентов смещает равновесие в стону образования продукта и наоборот.
Введение в реакционную смесь дополнительного количества инерта, смещает равновесие в сторону образования продукта, если реакция идет с увеличением объема газообразных реагентов, и в сторону образования исходных веществ если идет с уменьшением объема газообразных реагентов.
Третье свойство состояния равновесия. В состоянии равновесия свободная энергия, реагирующей системы =0. для изобарно-изотермического процесса 
Для изохорно-изотермического процесса 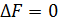
 2014-02-12
2014-02-12 2188
2188
