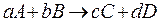
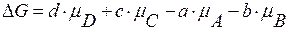
где µ – химический потенциал. Для любого i-ого вещества: µ=µi°+R∙T∙lnPi;
µi° – химический потенциал в стандартных условиях:
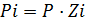 – закон Дальтона;
– закон Дальтона;
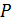 – общее давление;
– общее давление;
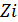 – мольная доля i-ого компонента.
– мольная доля i-ого компонента.
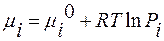 ;
; 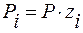
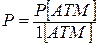
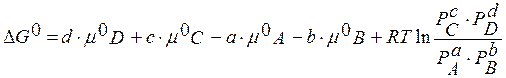
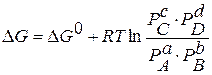
В равновесии скорость прямой реакции равна скорости обратной, т.е.
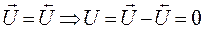
Из закона действующих масс:
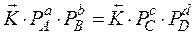
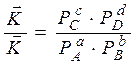 ;
;
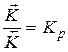 - отношение констант прямой и обратной реакций есть термодинамическая константа равновесия.
- отношение констант прямой и обратной реакций есть термодинамическая константа равновесия.
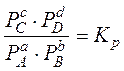
Используя закон Дальтона, получаем уравнение для расчета равновесных мольных долей компонента.
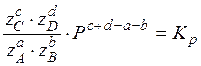 ,
,
она позволяет численно отслеживать изменение равновесия.
Используя третье свойство:
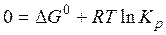
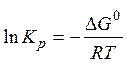
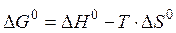
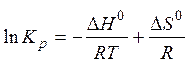
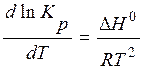
Если реакция экзотермическая: 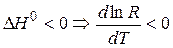
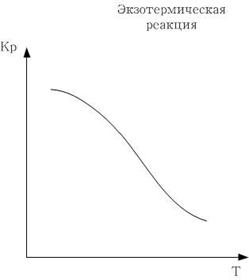
С увеличением температуры, константа термодинамического равновесия уменьшается.
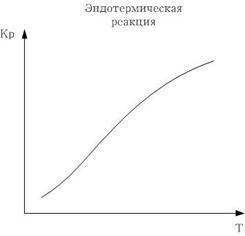
Для эндотермической реакции все наоборот - константа возрастает.
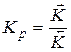
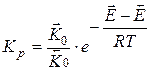
Прологарифмировав получим:
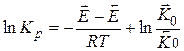
Таким образом, 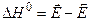 - изменение энтальпии реакции в стандартных условиях есть разность энергии активации прямой и обратной реакции.
- изменение энтальпии реакции в стандартных условиях есть разность энергии активации прямой и обратной реакции.
Для экзотермической реакции энергия активации прямой реакции меньше энергии активации обратной.
|
|
|
Для эндотермической реакции всё наоборот.
Изменение энергии активации прямой реакции влечет за собой изменение энергии активации обратной реакции.
Изменение энтропии 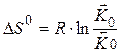
Т.е. предэкспоненциальный множитель в уравнении Аррениуса связан с энтропией.
 2014-02-12
2014-02-12 1164
1164








