Применим уравнение (1) к изобарному процессу (р = const).
Для 1 моль вещества
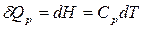 ;
;
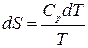 ,
,
где С р – молярная изобарная теплоемкость вещества, Дж/(моль×K).
Проинтегрируем последнее уравнение в определенных пределах (при изменении температуры от Т 1 до Т 2):
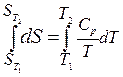 . (2)
. (2)
Если в исследуемом температурном интервале теплоемкость мало зависит от температуры, т.е. можно использовать среднюю изобарную теплоемкость 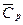 , то решение уравнения (2) имеет вид:
, то решение уравнения (2) имеет вид:
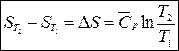 . (3)
. (3)
Изменение энтропии в ходе химической реакции (при Т = const) .
Так как энтропия – функция состояния, то ее изменение в ходе химической реакции можно рассчитать по уравнению:
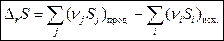 , (4)
, (4)
где Sj, Si – энтропии продуктов реакции и исходных веществ соответственно при температуре реакции; nj, ni – стехиометрические коэффициенты.
В справочной литературе приведены стандартные энтропии веществ при температуре 298 К.
Если реакция протекает при температуре, отличной от 298 К, то энтропию вещества рассчитывают по уравнению (3), приняв для удобства за Т 1 температуру 298, а за Т 2 – температуру реакции:
|
|
|
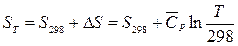 , (5)
, (5)
где D S – изменение энтропии вещества при нагревании (или охлаждении) вещества от 298 К до температуры Т.
После подстановки (5) в формулу (4) для каждого участника реакции получим формулу для расчета изменения энтропии в ходе реакции, протекающей при температуре Т:
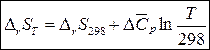 ,
,
где 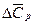 – разность между изобарными теплоемкостями продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов.
– разность между изобарными теплоемкостями продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов.
 2014-02-12
2014-02-12 3112
3112
