В изолированной системе со стационарными потенциальными силами увеличение внутренней энергии равно уменьшению механической энергии.
Изолированная система может совершать работу сама над собой, если это работа сил сопротивления.
 .
.
Следовательно, закон сохранения энергии в изолированной системе выполнится тогда и только тогда, когда
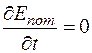
То есть
Значит,
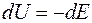 .
.
Следовательно,
А закон изменения механической энергии является механической формой I-го начала ТД, т.е. закона сохранения энергии Вселенной.
#5. Теплоемкости идеального газа.
Определение: теплоемкость – это физическая величина, равная количеству тепла, получаемого системой и необходимого для увеличения её температуры на один градус. В переводе на язык формул:
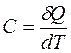 , следовательно, dQ=C×dT.
, следовательно, dQ=C×dT.
Поскольку Т - это функцией состояния, то мы используем значок дифференциала в её элементарной вариации, а поскольку dQ не является полным дифференциалом, то выражение C×dT должно нести в себе информацию о процессе, следовательно, теплоемкость С является характеристикой процесса, т.е.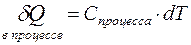 .
.
Рассмотрим I-е начало в различных равновесных процессах идеального газа.
Общее выражение закона:
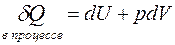 .
.
Т.к. рассматривается равновесный случай, то мы имеем право написать: p=p (V,T), следовательно, U=U (V,p (V,T))= U (V,T). Тогда
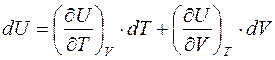 .
.
Подставляя в общее выражение I-го начала, получаем:
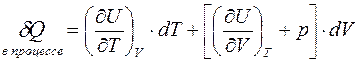 .
.
1. Изохорный процесс: dV= 0. Следовательно,
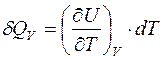 ,
,
тогда множитель при dT – это теплоемкость при постоянном объеме, т.е.,
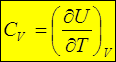
2. Изобарный процесс:
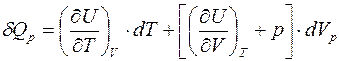 .
.
Из уравнения Менделеева-Клапейрона: 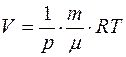 ,
, 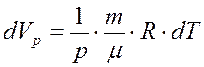 . Подставляем в первое начало:
. Подставляем в первое начало:
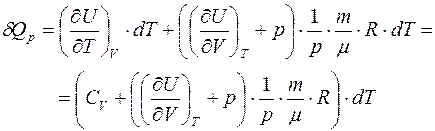 ,
,
следовательно,
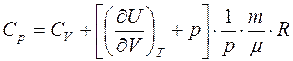
Как будет рассказано далее, Джоуль экспериментально установил, что внутренняя энергия идеального газа зависит только от температуры (не зависит от объема), т.е. для идеального газа
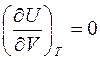 ,
,
и тогда получаем уравнение Майера: в случае идеального газа
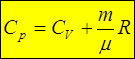
3. Адиабатический процесс. Из адиабатичности процесса следует dQ= 0; из идеальности газа в соответствии с законом Джоуля: dU=CVdT; из уравнения Менделеева-Клапейрона: 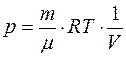 , т.е. элементарная работа
, т.е. элементарная работа 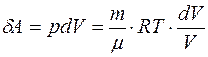 . Подставляя полученные выражения для элементарных величин, входящих в первое начало, получаем:
. Подставляя полученные выражения для элементарных величин, входящих в первое начало, получаем:
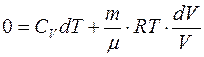 .
.
С учётом уравнения Майера:
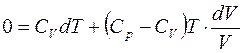
Поделим обе части равенства на Т:
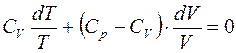 , т.е.
, т.е.
СV×d (ln T)+(Cp-CV)× d (ln V)=0.
Поделим равенство на СV и введем обозначение: 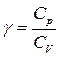 , тогда:
, тогда:
d (ln T)+(g- 1)× d (ln V)=0.
Из опыта известно, что теплоемкости идеального газа Ср и СV не зависят ни от каких термодинамических величин. Следовательно, из последнего равенства следует:
d (ln T +(g- 1)×ln V)=0 Þ d (ln T × Vg- 1)=0 Þ 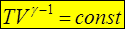
Это – уравнение Пуассона в TV- осях. Из уравнения Менделеева-Клапейрона 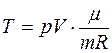 . Для газа определенной массы и химического состава последний множитель является константой, следовательно, уравнение Пуассона в pV -осях
. Для газа определенной массы и химического состава последний множитель является константой, следовательно, уравнение Пуассона в pV -осях
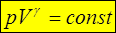
#6. Работа в различных равновесных процессах идеального газа.
1. Ap:
Ap = p× (V2-V1)
2. AT:
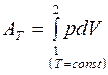 ;
; 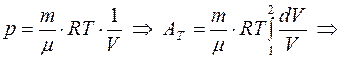
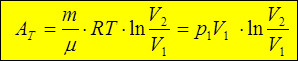
3. AQ:
0= DU+AQ Þ AQ =- DU Þ 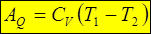 .
.
#7. Процесс Джоуля-Томпсона.
В параграфе 5 упоминалось экспериментальное доказательство Джоулем того факта, что в случае, когда уравнением состояния газа является уравнение Менделеева-Клапейрона, внутренняя энергия газа зависит только от его температуры и не зависит от объема.
Здесь необходимо отметить, что если газ расширяется в пустоту, то работы он не производит. В принципе, возможно было бы организовать адиабатическое расширение газа в пустоту и сравнивать начальное и конечное состояния газа:
0= dU+ 0, т.е. dU= 0.
Считая, что U=U (T,V) получим, что
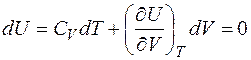 .
.
И если эксперимент покажет, что dT =0, то и 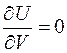 . Но такой процесс газа не является равновесным, и для того, чтобы получить температуру газа после расширения, нужно ждать, когда газ уравновесится. При этом его уравновешивание происходит не только "внутри себя", но и с сосудом, в котором он находится. Из-за большой теплоемкости сосуда по сравнению с теплоемкостью самого газа результат опыта был бы настолько неточным, что из него невозможно было бы сделать никаких выводов.
. Но такой процесс газа не является равновесным, и для того, чтобы получить температуру газа после расширения, нужно ждать, когда газ уравновесится. При этом его уравновешивание происходит не только "внутри себя", но и с сосудом, в котором он находится. Из-за большой теплоемкости сосуда по сравнению с теплоемкостью самого газа результат опыта был бы настолько неточным, что из него невозможно было бы сделать никаких выводов.
Вопрос был решён при исследовании процесса Джоуля-Томпсона: медленного, т.е. равновесного, протекания газа через капилляр в результате перепада давления на концах капилляра. Другое название этого процесса – дросселирование.


p1 и p2 – постоянные, p2 - p1 = dp <0. Слева и справа дросселя газ равновесный. Теплоизоляция системы обусловливает адиабатичность процесса. Малая пропускная способность дросселя обусловливает медленность течения газа. В результате, вязким трением газа в дросселе можно пренебречь и кинетической энергией газа как целого – тоже т.к. и то, и другое зависит от скорости газа квадратично.
Над газом в процессе дросселирования совершается работа A'p 1 =p 1 V 1. В то же время газ совершает работу Ap 2 =p 2 V 2. Т.е. полная работа, совершаемая газом
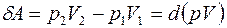 .
.
Если выразить U в равновесных начальном и конечном состояниях через V и T, то
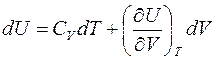 .
.
Подставляя полученные выражения работы и изменения внутренней энергии в первое начало ТД, с учётом адиабатичности процесса получаем:
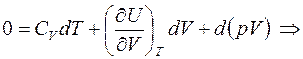
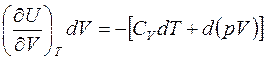
В случае идеального газа 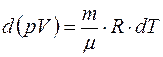 . Тогда
. Тогда

Экспериментально подтвержденное отсутствие изменения температуры идеального газа в результате дросселирования показало, что
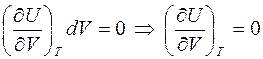
В реальных газах изменение температуры есть и это можно видеть, если открыть вентиль баллона со сжатым газом, который не является идеальным (эффект Джоуля-Томсона).
 2014-02-12
2014-02-12 378
378








