Основы гидрохимии.
3.1. Структура и свойства воды
Вода как химическое вещество состоит из кислорода и водорода, имеет формулу Н2О. Молекула воды – это сложно построенный диполь, его называют гидроль. Гидроли могут объединяться в ассоциации и определять структуру и многие свойства воды. Для льда наиболее устойчивой структурой являются тетраэдры, построенные из гидролей. При повышении температуры структурные связи нарушаются, плотность возрастает. При температуре + 4°С вода имеет наибольшую плотность, при дальнейшем повышении температуры усиливается частота теплового движения молекул, разрушается льдоподобная структура воды, что приводит к уменьшению ее плотности. Водяной пар не содержит структурных тэтраэдров. Основу его составляют свободные гидроли. Гидроли комплектуются в структуры посредством водородных и ковалентных связей. При нагревании воды эти связи становятся вакантными и способными к взаимодействию с другими веществами. Такая вода становится более активной. При рассмотрении структуры воды необходимо учитывать наличие воды в виде природных растворов, т. к. известно, что химически чистую воду найти в горных породах маловероятно. Вода является универсальным и наиболее активным растворителем.
3.2. Природа формирования растворов
Химический анализ любой пробы подземных вод покажет наличие в ней множества элементов. Такое разнообразие химического состава подземных вод обусловлено их геологической историей и постоянным взаимодействием с веществом Земли.
Процессы формирования химического состава природных вод весьма разнообразны. Прежде всего, это растворение минеральной и органической составляющей горных пород, ионный обмен, деятельность микроорганизмов, концентрирование за счет испарения, смешения и т.д.
Некоторая часть молекул воды способна диссоциировать на ионы: 2 Н2О ↔ Н3О + ОН¯. Из реакции диссоциации видно, что вода может обладать и кислыми, и щелочными свойствами. В качестве характеристики кислотности или щелочности раствора используют показатель концентрации ионов Н+ или ОН¯, взятых с обратным знаком, обозначая его символом РН. Значение РН < 7 будет соответствовать преобладанию ионов Н+ и характеризовать среду как кислую, РН = 7 соответствует нейтральной среде, РН > 7 характеризует щелочную реакцию. Низкие значения РН (0.5 – 3.0) характерны для рудничных вод сульфидных месторождений. Высокие значения РН (8.5-11.5) свойственны содовым водам.
Характеристикой способности подземных вод к окислительным или восстановительным реакциям является окислительно-восстановительный потенциал Eh. При этом считают, что при положительных Eh преобладают окислительные процессы, а при отрицательных – восстановительные. При рассмотрении состава подземных вод следует иметь в виду различную растворимость минералов, особенно породообразующих. Наибольшей растворимостью обладают хлориды (галит, сильвин и др.), менее растворимы сульфаты (гипс, ангидрит). Еще меньше растворимы карбонаты (кальцит, доломит). Растворимость силикатов очень мала. На растворимость почти всех минералов значительное влияние оказывает температура. Кроме того, подземные воды могут содержать коллоидные частицы и взвеси. В виде коллоидов чаще всего находятся органические компоненты, соединения гуминовых кислот, окрашивающих воду. Механические взвеси (суспензии) и эмульсии образуют глинистые и пылевые частицы.
В природном виде выделяются две большие группы: макрокомпоненты и микрокомпоненты. К макрокомпонентам относятся такие компоненты, которые определяют химический тип воды как природного раствора. В макрокомпонентный состав входят различные ионы – их 6.
Суммарное весовое количество твердых неорганических веществ называется общей минерализацией (мг/л, г/л).
Сухой остаток получается при выпаривании определенного объема воды. Чаще всего величины общей минерализации и сухого остатка не совпадают из-за органики (Сорг).
По величине общей минерализации различают воды: пресные до 1 г/л, солоноватые 1-10 г/л, соленые 10-50 г/л, рассолы > 50 г/л.
3.3. Анализ воды и способы его выражения
Анализ воды – это определение ее химического, газового, микробиологического состава. В зависимости от целей исследования в водах определяют: физические и органолептические свойства.
Виды и методы анализов определяются целями исследований и необходимой точностью.
Полный химический анализ выполняется специализированными лабораториями. Определяются все макро – и микрокомпоненты. Сокращенный химический анализ проводится также в стационарных лабораториях. Содержание Na+, K+, агрессивная углекислота, определяются расчетом. Полевой анализ – расчетом определяются Na+K, Ca, Mg, общая минерализация. Результаты химического анализа воды выражаются по-разному. Наиболее распространен способ выражения компонентов в 3-х размерностях: мг/л, мг-экв/л, мг-экв/%.
3.4. Классификация подземных вод по химическому составу
Наблюдения и аналитические исследования группируются в определенную систему не только с учетом статистики, но и с генетической позиции. Такая группировка может считаться универсальной классификацией.
Опубликованные классификации имеют ряд недостатков (или характерны для определенного региона, или определенных разновидностей вод и т.д.).
В гидрогеологии наиболее часто употребляются классификации О.А.Алекина, В.А.Сулина, Н.И.Толстихина и др.
В них различны методы группировки, способы изображения и названия признаков и показателей состава вод. Их достоинства – простота, логичность, стройность внутреннего построения.
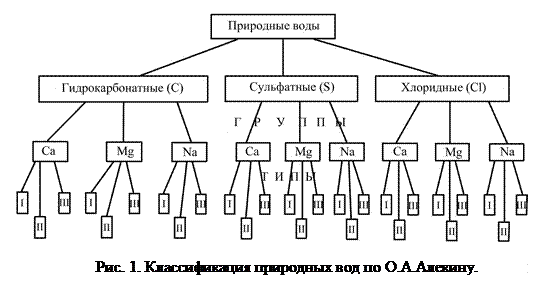 |
По общей минерализации в большинстве классификаций выделяются 4 группы подземных вод: пресные до 1 г/л, солоноватые от 1 до 10 г/л, соленые от 10 до 50 г/л, рассолы свыше 50 г/л. По классификации О.А.Алекина (рис. 1) по преобладающему аниону все воды делятся на классы: гидрокарбонатный (С), сульфатный (S) и хлоридный (Сl). На следующем уровне каждый из классов делится на 3 группы по преобладающему катиону: кальциевая (Ca), магниевая (Мg) и натриевая (Na) группы.
Дальнейшее деление групп на типы производится по характерным соотношениям микрокомпонентов:
1 тип НСО3 > Ca + Mg
2 тип HCO3 < Ca + Mg
3 тип HCO3 + SO4 < Ca + Mg
4 тип НСО3 = О.
На практике для обозначения единичных химических анализов широко используется формула М.Г.Курлова, которая имеет следующий общий вид:
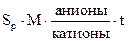 ,
,
где Sp – специфический элемент, содержащийся в воде;
М – общая минерализация в г/л;
t – температура воды в °С.
Формула М.Г.Курлова представляет собой дробь, в числителе которой располагаются анионы (в % экв.) в порядке убывания их содержания, а в знаменателе – в таком же порядке катионы.
Запись формулы М.Г.Курлова имеет вид:
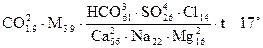 .
.
В приведенном примере наименование состава выраженной формулой воды будет: углекислая, гидрокарбонатно-сульфатно-хлоридная, кальциево-натриево-магниевая.
В последнее время в формуле показывают все анионы и катионы, содержание которых превышает 1 мг-экв/%. Это дает возможность более четко представить условия формирования химического состава подземных вод. Кроме того, по предложению А.М.Овчинникова (1963) и других ученых наименование состава воды рекомендуется проводить, ставя впереди анионы и катионы, находящиеся в подчиненном количестве, и включая только те из них, содержание которых также превышает 25 % экв. С учетом этого предложения название воды, состав которой приведен в написанной выше формуле, будет: углекислая, хлоридно-сульфатно-гидрокарбонатная, магниево-натриево-кальциевая.
Контрольные вопросы.
1. С какими структурными особенностями воды связаны ее свойства?
2. Действие каких факторов сказывается на процессах формирования состава подземных вод?
3. Что показывает величина концентрации водородных ионов, какие характерные значения ее в подземных водах?
4. Какая связь состава подземных вод с растворимостью породообразующих минералов?
5. Каким образом количественно оценивается химический состав подземных вод?
6. Как классифицируют подземные воды по химическому составу?
 2014-02-13
2014-02-13 864
864






