Введение
Водно-химические режимы (в дальнейшем просто - водные режимы) тепловых и атомных электростанций, как показала отечественная и мировая практика, являются определяющими по своему влиянию на надежность, экономичность и безопасность работы теплоэнергетического оборудования, в первую очередь –парогенерирующего, а также на эксплуатационную надежность энергоблоков в целом. Поэтому при подготовке специалистов по тепловой и атомной энергетике обойти изучение особенностей организации водных режимов невозможно. А для специальности “Технологии теплоносителей и поведения с РАВ на АЭС ”, которая формирует специалистов-энергетиков в этой отрасли техники и науки, дисциплина «Водные режимы АЭС» является одним из базовых курсов.
Цель дисциплины – сформировать в сознании специалистов концепцию организации водно-химических режимов (ВР) на АЭС, подготовить их к практической деятельности относительно обеспечения надёжной работы энергетического оборудования путем сведения к минимуму интенсивности процессов отложений примесей и коррозионных процессов, которые в них происходят.
Задача дисциплины состоит в систематизации и приобретении знаний о закономерностях физико-химических процессов (коррозии, шламообразования, образования отложений и накипи, загрязнения пара, радиолизу и др.), которые происходят в циклах электростанций, и навыков системного подхода к анализу, расчетам и коррекции водных режимов с учетом гидродинамических, тепловых и химических факторов при их совместном проявлении.
После изучения дисциплины студент должен знать:
- основные закономерности физико-химических преобразований примесей в тракте блоков;
- пути проникновения примесей в рабочее тело, методы их удаления;
- особенности и закономерности концентрирования примесей в парогенераторной воде парогенераторов (ПГ) АЭС;
- допустимые правилами технической эксплуатации разновидности ВР конденсатно-питательного тракта, парогенераторов, испарителей;
- конкретные схеми организации ВР блоков, технологию использования коррегирующих добавок, конструкцию и принцыпы работы устройств, которые используются при организации ВР отдельных элементов схемы (паропромывных устройств, сепараторов, блочных обессоливающих установок (БОУ), деаераторов и др.);
- современные тенденции по совершенствованию ВР энергетических установок.
Должен уметь:
- рассчитать концентрации примесей в конденсате, питательной воде, парогенераторной воде с учетом присосов природной воды, процессов коррозии и отложений;
- оценить количественно интенсивность (скорость) коррозии и отложений, состав рабочего тела в любой точке тракта теплоэнергетической установки;
- рассчитать вероятную продолжительность межпромывного периода работы блока или отдельных его элементов и элементов котлов;
- выполнять проектные и поверочные расчеты устройств, которые обеспечивают ВР АЭС (БОУ, СВО-5,паропромивные и сепарационные устройства, дозирующие устройства и др.)
Розвитие энергетики сопровождается наращиванием мощности энегоблоков, что позволяет повышать их экономичность и понижать металлоемкость. Но такая тенденция значительно повышает требования к надёжности работы блоков. Например, остановка блока в 1000 МВт на протяжении одних суток ведет к экономическим потерям на несколько млн. грн.. Связь с экономичностью и надежностью работы блоков и водными режимами состоит в следующем. Если водные режимы не выдерживаются или качество теплоносителей не достаточно, то это ведет к: а) избыточной интенсивности коррозионных процессов; б) избыточным отложениям, накипи. Коррозия ведет в дальнейшем к уменьшению толщины металла труб, которые образуют поверхность нагрева, падает его прочность, а потому увеличивается вероятность аварий, отказов отдельного оборудования, остановок энергоблока. Появление отложений ведет к понижению мощности реактора, блока, ПГ, теплообменников и др., а также увеличивает вероятность отказа оборудования или его аварийного выхода из рабочего состояния. Эта связь вытекает из уравнений, известных из курса тепломассообмена, по которым суммарное термическое сопротивление включает сопротивление отложений толщиной δо, м и теплопроводностью λо, Вт/(м К). Появления отложений ведет к
возрастанию термического сопротивления и уменшению тепловой мощности соответствующего аппарата.
В случае высокотемпературных поверхностей нагрева появление накипи ведет к неконтролируемому изменению(повышению) температуры металла труб.
Отложения ведут также к снижению эффективности работы турбины.
Следует подчеркнуть, что изменения ВХР протекают не независимо, а в тесной взаимосвязи с другими изменениями (например, кратковременное повышение мощности дает толчек отложениям, нарушение плотности концевых уплотнений конденсатного насоса ведет к всасыванию воздуха и появлению в водяном тракте кислорода и углекислого газа и др.).
Главные задачи организации ВР на АЭС:
- поддержание чистоты конденсата, питательной воды и пара (или обобщенно - теплоносителей) на уровне, который соответствует требованиям ПТЭ (правил технической эксплуатации);
-предупреждение отложений;
- уменьшение интенсивности коррозии.
Освоение этого курса должно ответить на вопрос, а как это сделать? Это невозможно без знаний предыдущих курсов:ТОХТП, ТМО, ТЕС и АЕС, оброботка воды, и т.д.
Вообще паролями, ключевыми словами этого курса являются: отложения, коррозия.
Тема 1. Параметры (показатели) водных режимов
1.1. Показатели ВР.
Эти показатели изучались нами в курсе тепловые сети и их
водные режимы. Обычно они составляют нормы ведения водного режима не зависимо от устройств.
Нормы - это совокупность выявленных практикой параметров, которые обеспечивают надежную и длительную эксплуатацию энергоблоков электростанций.
Организовать водный режим это значит строго выдерживать нормы водного режима.
Среди показателей ВР есть фундаментальные, найболее употребляемые: это рН, удельная электропроводность и величина, которая появилась в последнее время - редокспотенциал, или окислительно-восстановительный потенциал еН. Главное достоинство этих показателей - это возможность их автоматизированного измерения, подобно давлениюи температуре.
Дополнительными показателями являются:
- жёрсткость (твёрдость);
- щелочность;
- концентрация Cl- іона,
- концентрация SiO2,
- концентраця кислорода,
- концентрации других газов СО2, Н2,NH3,
-концентрации других примесей, которые используются для коррекции водного режима: фосфаты, гидразин, комплексоны, и др..
Что такое рН? Формальный ответ – отрицательный десятичный логарифм мольной концентрации (активности) ионов водорода. Однако, и это очень важно, это понятие связано с законом действующих масс, а также с причинами, которые вызывают появление ионов водорода в воде. Этих причин две: диссоциация самой воды и диссоциация других соединений (в первую очередь кислот и щелочей, которые присутствуют в водном растворе, а также гидролиз соединений).
Диссоциация в воде имеет место всегда, независимо от того или это чистая вода, или это раствор какого-то соединения. Для понятия рН важно знание численного значения, которое соответствует нейтральному состоянию:
рНо=1/2рКw (1.1)
В этом уравнении индекс «о» при Н означає нейтральность, индекс р – отрицательный десятичный логарифм.
Уравнение (1.1) показывает связь понятия нейтрального значения рНо из понятием ионного произведения воды, вместе с тем свидетельствует о том, что нейтральность воды(растворов) при разных температурах и давлениях характеризуется разными числовыми значениями величины рНо, причем при температуре около 250 оС рНо достигает минимуму. Если при 25 оС рНо = 7, то при 250 оС эта величина снижается почти до 5,5.
Какие причины могут вызвать на ТЭС и АЭС отличие рН теплоносителя от нейтрального? Во-первых это наличие СО2. во-вторых, это разложение при повышенных температурах органических примесей. Эти факторы чаще всего вызывают снижение рН. Разложение бикарбонатов и гидролиз солей могут вызвать повышение рН. Корректируют рН в сторону его повышения с помощью аммиака или других аминов (морфолина, пиперидина, гидразина).
Понятие удельной электропроводности - χ, мкСм/ см заимствуется из электротехники с тем отличием, что в растворах носителями тока выступают ионы. Удельная электропроводность завист от температуры, характер этой зависимости рассмотрен ранее.
Что таке еН?
еН - это окислительно-восстановительный потенциал, который может буть рассчитан по уравнению Нернста:
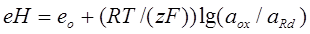 , (1.2)
, (1.2)
где аox и аRd - активности (концентрации) соответственно ионов, которые ркислились и ионов, которые восстановились;
z –заряд;
F =96,485 103 Кл –постоянная Фаррадея;
R- газовая постоянная;
T- температура;
eo- стандартный (нормальный) окислительно-восстановительный потенциал системы.
Показатель еН прежде всего нужен для прогноза и предупреждения коррозии.
Другие показатели ВР являются традиционными для оценки качества водных растворов.
1.2.Растворимость твердых примесей в воде
Растворимостью (S) называют предельную клнцентрацию примеси в растворе в условиях ёё равновесия с нерастворённым твёрдым веществом.
Растворимость может быть выражена какой-либо единицей концентрации. Растворимость зависит от температуры.
На отдельных участках тепловой схемы АЭС теплоноситель имеет различное название. Это связано не только с термическим состоянием воды, но также с ёё качественным составом. С этой точки зрания различают:
- конденсат;
- питательную воду;
- дренажи конденсата;
- охлаждающую воду в конденсаторе;
- продувочную воду;
- воду теплосети
- воду первого контура.
Примеси вод АЭС возможно разделить на природные, которые проникнают в контур с природной водой, и искуственные, которые являются продуктами коррозии и коррекции водного режима.
Где проникают природные примеси:
- в конденсаторе;
- в подогревателях тепловой сети;
- с добавочной водой;
- из воздуха.
Что это за примеси? Продукты дисоциации разных веществ: катионы - Na+, K+, Ca2+, Mg2+, анионы - Cl-, SO42-, SiO32-, HCO3-, CO32-; колоидные примеси: SiO2, окислы металла, органические примеси; газовые: О2, СО2, N2 и др.. По тракту за счёт коррозии добавляются Fe, Cu, Al, за счет коррекции - щелочи, комплексоны, амины. В каком состоянии? В виде истинно растворенном, а также в коллоидном и в виде ГДП (грубо дисперсных примесей).
Чтобы не было накипи и она не образовывалась, нужно все время поддерживать примеси в истинно растворимом состоянии. Математически это условие задается неравенством
Cі < Sі, (1.3)
где Cі -концентрация примеси;
Sі - растворимость этой примеси.
По знаку температурного коэффициента растворимости dS/dt, судят опасно ли это вещество как накипеобразователь. Если он отрицателен, то вещество может давать накипь. Из перечисленных примесей соединения Ca и Mg труднорастворимы, и часть из них имеют отрицательный коэффициент растворимости и являются основными накипеобразователями (особенно для котлов низкого и среднего давления). Соединения Ca и Mg с анионами хлора, хорошо растворимы в воде, имеют положительный коэффициент растворимости и опасности не представляют. CaCO3, CaSO4, Mg(OH)2, труднорастворимы и имеют отрицательный коэффициент растворимости и являются наиболее опасными с точки зрения накипеобразования уже при низких температурах используемой воды.
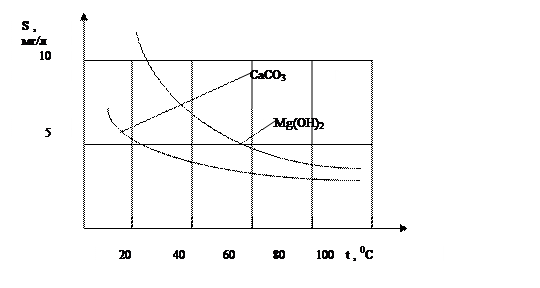
Рис.1.1. Растворимость в воде карбоната кальция и гидрата магния.
Кроме графиков (рис.1.1 и 1.2), которые отражают эксперементальные данные о растворимости индивидуальных веществ, о растворимости веществ можно судить по величине произведения растворимости.
Если известно произведение растворимости то по нему возможно рассчитать растворимость вещества в моль/л по уравнению:
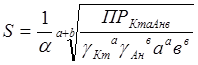 , (1.4)
, (1.4)
где α – степень дисоциации;
а і в – стехиометрические коэффициенты;
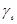 - соответствующие коэффициенты активности ионов.
- соответствующие коэффициенты активности ионов.
Данные о Пр имеются, например, в моем учебнике по ВР.
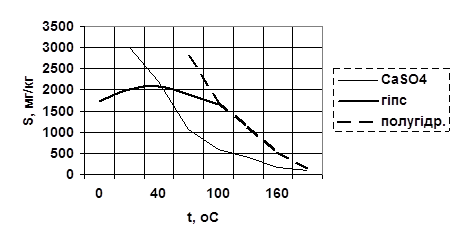 |
Рис.1.2. Растворимость разновидностей сульфатов.
При закритических параметрах воды (Р > 22,4 МПа, t > 374 oC) влияние диссоциации на растворимость незначительно, потому что ёё почти нет. Поэтому в таком состоянии воды растворимость примесей описывают иначе чем при низких параметрах и соотношение для растворимости в моль/л имеет вид:
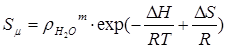 , (1.5)
, (1.5)
де 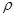 - плотность воды в г/см3 ;
- плотность воды в г/см3 ;
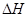 - изменение энтальпии растворения, Дж/моль;
- изменение энтальпии растворения, Дж/моль;
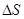 - изменение энтропии растворения, Дж/(моль К);
- изменение энтропии растворения, Дж/(моль К);
m - координационное число.
Как показали исследования, структура (1.5) достаточно хорошо подтверждается для растворимости компонентов в однофазной среде при закритических параметрах. Достаточно надежные результаты получаются также и для воды при высоких давлениях и температурах выше 200 оС.
В дополнение к приведенным данным, для расчетов растворимости окислов железа возможно использовать аппроксимацию даних, имеющихся в литературе
SFe = A1 t2 - B1 t + C1,
где коэффициенты вибирают из табл. 2.5, см. учебник
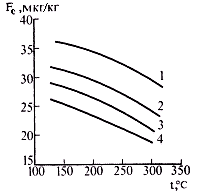
| Рисунок 2. Растворимость магнетита в кипящей воде в зависимости от ее температуры: 1 — рН=5,0; 2 — рН=5,5; 3 — 2рН=6,0; 4 — рН=7,0. |
 2015-01-30
2015-01-30 606
606







