Нитрат-ион NO 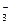 проявляет окислительные свойства. Они зависят от концентрации нитратов (азотной кислоты), реакции среды и активности восстановителя. Например, концентрированная HNO3 взаимодействует с сульфидами и сероводородом с образованием оксида азота(IV).
проявляет окислительные свойства. Они зависят от концентрации нитратов (азотной кислоты), реакции среды и активности восстановителя. Например, концентрированная HNO3 взаимодействует с сульфидами и сероводородом с образованием оксида азота(IV).
H2S + 8HNO3 = H2SO4 + 8NO2↑ + 4Н2О
Умеренно разбавленная HNO3 взаимодействует с образованием NO:
3H2S + 2HNO3 = 3S↓ + 2NO↑ + 4Н2О
Окислительная функция NO 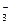 -иона используется для его дробного обнаружения с металлическим Zn или Al в сильно-основной среде – выделяется газообразный аммиак, обнаруживаемый по посинению влажной красной лакмусовой бумаги.
-иона используется для его дробного обнаружения с металлическим Zn или Al в сильно-основной среде – выделяется газообразный аммиак, обнаруживаемый по посинению влажной красной лакмусовой бумаги.
NO 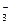 + 4Zn + 7ОН– = NH3↑ + 4 ZnO
+ 4Zn + 7ОН– = NH3↑ + 4 ZnO 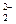 + 2Н2О
+ 2Н2О
NO 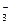 + 8Al + 21ОН– = 3NH3↑ + 8AlO
+ 8Al + 21ОН– = 3NH3↑ + 8AlO 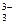 + 6Н2О
+ 6Н2О
Методика: к 4-5 каплям раствора, содержащего нитрат-ионы, прибавляют 6-7 капель концентрированного раствора NaOH и немного металлического цинка или алюминия. Пробирку неплотно закрывают ватой, поверх которой помещают влажную красную лакмусовую бумагу и нагревают на водяной бане. Бумага синеет. Открытию нитрат-ионов этой реакцией мешают NO 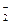 , NH
, NH 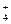 , SCN– и др.
, SCN– и др.
|
|
|
Анионы СН3СОО–, C6H5COO–, C6H4OHCOO– индифферентны по окислительно-восстановительным свойствам.
 2015-01-30
2015-01-30 3978
3978








