В наиболее общем виде образование химической связи происходит путем спаривания двух электронов, принадлежащих различным атомам. При этом возникает общая электронная пара (молекулярная орбиталь - МО), которая связывает эти атомы. Если МО имеет симметричное распределение электронной плотности, возникающая связь называется КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ (молекулы Н2, N2, О2, I2 и т.п.).
При смещении электронной плотности к ядру одного из атомов образуется КОВАЛЕНТНАЯ ПОЛЯРНАЯ связь (НСl, Н20, С02 и др.). При значительном смещении электронной плотности связь называют ИОННОЙ (NaCl, КВг, СаО и др.).
Способность атома смещать к себе электронную плотность МО оценивается величиной его электроотрицательности (ЭО)
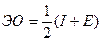 ,
,
где I - энергия ионизации атома, кДж/моль;
Е - сродство атома к электрону, кДж/моль.
ЧЕМ БОЛЬШЕ РАЗНОСТЬ ЭО АТОМОВ ВЗАИМОДЕЙСТВУЮЩИХ ЭЛЕМЕНТОВ, ТЕМ СИЛЬНЕЕ СМЕЩЕНИЕ ЭЛЕКТРОННОЙ ПЛОТНОСТИ К АТОМУ БОЛЕЕ ЭЛЕКТРООТРИЦАТЕЛЬНОГО ЭЛЕМЕНТА, ТЕМ ВЫШЕ ПОЛЯРНОСТЬ СВЯЗИ. С ДРУГОЙ СТОРОНЫ, ЧЕМ ВЫШЕ ПОЛЯРНОСТЬ СВЯЗИ, ТЕМ БОЛЕЕ СПОСОБНА ДАННАЯ ХИМИЧЕСКАЯ СВЯЗЬ К ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ В РАСТВОРАХ.
Для качественной оценки образующейся связи используют не абсолютные значения ЭО, а относительные (ОЭО). Если ЭО лития - 536 кДж/моль - принять за единицу, получают шкалу ОЭО элементов (приложение, табл. 1)
 2015-01-30
2015-01-30 507
507








