2.1 В озеро глубиной 20 м и площадью10 км2 бросили кристаллик поваренной соли массой 0,01 г. Сколько молекул этой соли оказалось бы в наперстке воды объемом 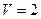 см3, зачерпнутом из этого озера, если считать, что соль, растворившись, равномерно распределилась по всему объему озера?
см3, зачерпнутом из этого озера, если считать, что соль, растворившись, равномерно распределилась по всему объему озера?
2.2 Оценить для железа: 1) число атомов в объеме 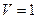 см3; 2) расстояние между центрами соседних атомов.
см3; 2) расстояние между центрами соседних атомов.
2.3 Оценить для газа при нормальных условиях: 1) число молекул в 1 см3; 2) среднее расстояние между соседними молекулами.
2.4 Вычислить концентрацию молекул газа при нормальных условиях.
2.5 Определить плотность углекислого газа при нормальных условиях.
2.6 Считая, что объем молекулы воды равен 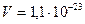 см3, найти, какой процент от всего пространства, занятого водой, приходится на долю самих молекул.
см3, найти, какой процент от всего пространства, занятого водой, приходится на долю самих молекул.
2.7 Считая, что диаметр молекул кислорода равен 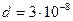 см, оценить, какой длины получилась бы нить, если все молекулы, содержащиеся в m = 1 мг кислорода, были расположены в один ряд, вплотную друг другу. Во сколько раз длина этой нити оказалась бы больше среднего расстояния от Земли до Луны?
см, оценить, какой длины получилась бы нить, если все молекулы, содержащиеся в m = 1 мг кислорода, были расположены в один ряд, вплотную друг другу. Во сколько раз длина этой нити оказалась бы больше среднего расстояния от Земли до Луны?
|
|
|
2.8 Хорошо откачанная лампа накаливания объемом V = 10 см3 имеет трещину, в которую ежесекундно проникает z = 106 молекул газа. Сколько времени понадобится для наполнения лампы до нормального давления, если скорость проникновения газа остается постоянной? Температура t = 0ºC.
2.9 За время t = 10 суток полностью испарилось из стакана m = 100 г воды. Сколько в среднем вылетало молекул с поверхности воды за 1 с?
2.10 Вычислить среднюю квадратичную скорость атомов гелия при температуре 27ºС.
2.11 При повышении температуры идеального газа на 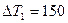 К средняя квадратичная скорость его молекул увеличилась с
К средняя квадратичная скорость его молекул увеличилась с 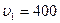 м/с до
м/с до 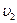 = 500 м/с. На сколько нужно нагреть газ, чтобы увеличить среднюю квадратичную скорость его молекул с
= 500 м/с. На сколько нужно нагреть газ, чтобы увеличить среднюю квадратичную скорость его молекул с 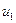 = 500 м/с до u 2 = 600 м/с?
= 500 м/с до u 2 = 600 м/с?
2.12 Определить концентрацию молекул углекислого газа при нормальном давлении и температуре t = 23 ºC. Сколько таких молекул будет содержаться в колбе емкостью V = 200 мл.
2.13 В закрытом сосуде находится идеальный газ. Как изменится его давление, если средняя квадратичная скорость его молекул увеличится на 20 %?
2.14 Кислород при температуре 77ºС и давлении 0,2 МПа занимает объем 10 л. Какова его масса?
2.15 В сосуде объемом 1,2 л находится 25 мг газа при температуре 27ºС и давлении 1,85 кПа. Какой это газ?
2.16 Когда из сосуда выпустили некоторое количество газа, давление в нем упало на 40%, а абсолютная температура уменьшилась на 10%. Какую часть газа выпустили?
2.17 При какой температуре находился газ, если при нагревании его на 20°С при постоянном давлении объем увеличился в два раза?
2.18 При температуре 27°С и давлении 12·105 Па плотность смеси водорода и азота равна 10 г/дм3. Определить молярную массу смеси.
|
|
|
2.19 Определить внутреннюю энергиюводорода, а также среднюю кинетическую энергию молекулы этого газа при температуре 300 К, если количество вещества этого газа равно 0,5 моль.
2.20 Стеклянная, запаянная с одного конца трубка открытым концом опущена в сосуд со ртутью. После подъема трубки
уровни ртути в сосуде и трубке совпадают. При этом длина
части трубки, занятой воздухом, 100 см. Затем трубку поднимают на 10 см. Какой будет после этого высота уровня ртути в трубке, если атмосферное давление 1,05∙105 Па? Капиллярными явлениями пренебречь.
2.21 Средняя кинетическая энергия поступательного движения каждой молекулы газа равна 5 ·10-21 Дж. Концентрация молекул 3∙1019 см -3. Определить давление газа.
2.22 Водород находится при температуре 300 К. Найти среднюю кинетическую энергию вращательного движения одной молекулы, а также суммарную кинетическую энергию всех молекул этого газа; количество водорода 0,5 моль.
2.23 При какой температуре средняя кинетическая энергия поступательного движения молекулы идеального газа равна 4,14∙10-21Дж?
2.24 При нормальных условиях 1л газа имеет массу 1,4∙10-3кг. Определить: а) плотность газа; б) его молярную массу; в) число молекул в данной массе газа.
2.25 Определить суммарную кинетическую энергиюпоступательного движения всех молекул газа, находящегося в сосуде вместимостью 3 л под давлением 540 кПа.
2.26 Количество вещества гелия 1,5 моль, температура120 К. Определить суммарную кинетическую энергиюпоступательного движения всех молекул этого газа.
2.27 Определить среднюю квадратичную скорость < 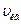 > молекулы газа, заключенного в сосуд вместимостью 2 лпод давлением 200 кПа. Масса газа m = 0,3 г.
> молекулы газа, заключенного в сосуд вместимостью 2 лпод давлением 200 кПа. Масса газа m = 0,3 г.
2.28 Водород находится при температуре 300 К. Найти среднюю кинетическую энергию <Wвр> вращательного движения одной молекулы, а также суммарную кинетическую энергию WK всех молекул этого газа; количество водорода v = 0,5 моль.
2.29 В азоте взвешены мельчайшие пылинки, которые движутся так, как если бы они были очень крупными молекулами. Масса каждой пылинки равна 6 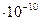 г. Газ находится при температуре 400 К. Определить средние квадратичные скорости <
г. Газ находится при температуре 400 К. Определить средние квадратичные скорости < 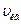 >, а также средние кинетические энергии поступательного движения <Wк> молекулы азота и пылинки.
>, а также средние кинетические энергии поступательного движения <Wк> молекулы азота и пылинки.
2.30 Определить среднюю кинетическую энергию <Wк> поступательного движения и вращательного <Wвр> движения молекулы азота при температуре Т = 1 кК. Определить также полную кинетическую энергию W молекул при тех же условиях.
2.31 Воздух в открытом сосуде медленно нагрели до 400 К, затем, герметически закрыв, сосуд охладили до 280 К. На сколько при этом изменилось давление газа в сосуде?
2.32 Во сколько раз увеличится объем воздушного шара, если его внести с улицы в теплое помещение. Температура на улице –3ºС, в помещении +27ºС.
2.32 Объем некоторой массы газа при нагревании на 10 К при постоянном давлении увеличился на n = 3% от своего первоначального объема. Определить начальную температуру газа.
2.33 Какая масса воздуха выйдет из комнаты, если температура воздуха возросла с 10ºC до 20ºС? Объем комнаты 60м3. Давление нормальное.
2.34 Внутри закрытого с обоих концов горизонтального цилиндра имеется тонкий поршень, который может скользить в цилиндре без трения. С одной стороны поршня находится водород массой 3 г, с другой – азот массой 23 г. Какую часть объема цилиндра занимает водород?
2.35 Какова плотность воздуха в сосуде, емкость которого 2 л, если сосуд откачан до 10-3 мм рт. ст., а температура воздуха 15°С? Как и насколько изменится плотность воздуха в сосуде, если добавить в него 5∙10-8 кг воздуха? Какое давление установится в сосуде? Процесс происходит при постоянной температуре.
|
|
|
2.36 В баллоне, емкость которого 20 л, находится 150 г смеси водорода и азота. Давление газовой смеси 1·106 Па, температура в баллоне 17°С. Каковы массы азота и водорода в баллоне?
2.37 В сосуде объемом 10 л содержатся 15 г углекислого газа и 5 г водорода при температуре 300 К. Определить давление в сосуде при таких условиях, а также давление после нагревания смеси до 400 К.
2.38 В закрытом сосуде содержится смесь газов, состоящая из 100 г углекислого газа и 150 г азота. Определить плотность смеси при температуре 27 °С и давлении 760 мм рт. ст.
2.39 Какой объем занимает смесь азота массой 1 кг и гелия массой 1 кг при нормальных условиях?
2.40 В баллоне вместимостью 15 л находится смесь, содержащая 10 г водорода, 54 г водяного пара и 60 г оксида углерода. Температура смеси 27 °С. Определить давление.
2.41 В стальной баллон емкостью 10 л нагнетается водород при температуре 290 К. Сколько водорода можно поместить в баллон, если допустимое давление на стенки баллона 50 МПа?
2.42 Два сосуда, содержащих одинаковую массу одного и того же газа, соединены трубкой с краном. В первом сосуде давление 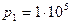 Па, а во втором
Па, а во втором 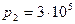 Па. Температура в сосудах одинакова. Какое установится давление после открытия крана?
Па. Температура в сосудах одинакова. Какое установится давление после открытия крана?
2.43 В сосуд объемом 1 л помещают кислород массой 2 г и азот массой 4г. Каково давление смеси при температуре 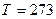 К?
К?
2.44 В сосуде объемом 1,5 л находится смесь кислорода и углекислого газа. Масса смеси 40 г, температура 300 К, давление 2 МПа. Найти массу каждого из газов.
2.45 В закрытом сосуде находится воздух и капля воды массой 1 г. Объем сосуда 75 л, давление в нем 12 кПа и температура 290 К. Каким будет давление в сосуде, когда капля воды испарится?
2.46 Найти число молекул гелия в 1 см3, скорости которых лежат в интервале от 2,39∙103 до 2,41∙103 м/с. Температура гелия 690 °С, его плотность 2,16∙104 кг/м3.
2.47 Найти относительное число молекул газа, скорости которых отличаются не более чем на 1% от наивероятнейшей скорости.
2.48 Считая, что сухой воздух состоит из 78 % азота, 21 % кислорода и 1% аргона (по объему), определить, какая часть молекул от общего их числа при температуре 20°С движется со скоростями от 350 до 360 м/с.
|
|
|
2.49 Какая часть молекул азота при температуре 150 °С имеет скорости, лежащие в интервале от 300 до 800 м/с?
2.50 Определить высоту горы, если давление на ее вершине равно половине давления на уровне моря. Температуру считать постоянной и равной 0°С.
2.51 На какой высоте давление воздуха составляет 75 % от давления на уровне моря? Температуру воздуха считать постоянной и равной 0°С.
2.52 Обсерватория расположена на высоте 3250 м над уровнем моря. Найти давление воздуха на этой высоте. Температуру воздуха считать постоянной и равной 15°С. Молярную массу воздуха считать известной. Давление воздуха на уровне моря составляет 101,3 кПа.
2.53 При подъеме вертолета на некоторую высоту барометр, находящийся в его кабине, изменил свое показание на 11 кПа. На какой высоте летит вертолет, если на взлетной площадке барометр показывал 0,1 МПа? Температуру воздуха считать постоянной и равной 17°С.
2.54 В цилиндр длиной 1,6м, заполненный воздухом при нормальном атмосферном давлении p о, начали медленно вдвигать поршень площадью основания 200 см2. Определить силу F, действующую на поршень, если его остановить на расстоянии 10 см от дна цилиндра.
2.55 В баллоне находится газ при температуре T 1 = 400 К. До какой температуры Т 2надо нагреть газ, чтобы его давление увеличилось в 1,5 раза?
2.56 Баллон вместимостью 20 л заполнен азотом при температуре 400 К. Когда часть газа израсходовали, давление в баллоне понизилось на 200 кПа. Определить массу m израсходованного газа. Процесс считать изотермическим.
2.57 В баллоне вместимостью 15 л находится аргон под давлением 600 кПа и при температуре 300 К. Когда из баллона было взято некоторое количество газа, давление в баллоне понизилось до 400 кПа, а температура установилась 260 К Определить массуаргона, взятого из баллона.
2.58 Два сосуда одинакового объема содержат кислород. В одном сосуде давление p 1= 2 МПа и температура T 1= 800 К, в другом p 2 = 2,5 МПа, T 2= 200 К. Сосуды соединили трубкой и охладили находящийся в них кислород до температуры T = 200 К. Определить установившееся в сосудах давление p.
2.59 Определить относительную молекулярную массу Мr газа, если при температуре154 К и давлении 2,8 МПа он имеет плотность 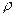 = 6,1 кг/м3.
= 6,1 кг/м3.
2.60 В сосуде вместимостью 40 л находится кислород при температуре 300 К. Когда часть газа израсходовали, давление в баллоне понизилось на 100 кПа. Определить массу израсходованного кислорода. Процесс считать изотермическим.
2.61 В атмосферном воздухе на долю азота приходится 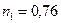 массы, а на долю кислорода
массы, а на долю кислорода 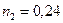 (если пренебречь примесями других газов). Вычислить молярную массу воздуха.
(если пренебречь примесями других газов). Вычислить молярную массу воздуха.
2.62 Определить молярную массу 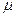 двухатомного газа и его удельные теплоемкости, если известно, что разность ср – cv удельных теплоемкостей этого газа равна 260 Дж/(кг ∙К).
двухатомного газа и его удельные теплоемкости, если известно, что разность ср – cv удельных теплоемкостей этого газа равна 260 Дж/(кг ∙К).
2.63 Определить показатель адиабаты 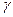 идеального газа, который при температуре Т = 350 К и давлении р = 0,4 МПа занимает объем V = 300 ли имеет теплоемкость Сv = 857 Дж/К.
идеального газа, который при температуре Т = 350 К и давлении р = 0,4 МПа занимает объем V = 300 ли имеет теплоемкость Сv = 857 Дж/К.
2.64 Определить относительную молекулярную массу Мr, молярную массу 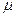 газа, если разность его удельных теплоемкостей cp− cv = 2,08 кДж/(кг∙К).
газа, если разность его удельных теплоемкостей cp− cv = 2,08 кДж/(кг∙К).
2.65 Определить среднюю длину свободного пробега 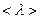 молекулы азота при н/у в сосуде вместимостью 5 л. Масса газа m = 0,5 г.
молекулы азота при н/у в сосуде вместимостью 5 л. Масса газа m = 0,5 г.
2.66 Водород находится под давлением 20 мкПа и имеет температуру 300 К. Определить среднюю длину свободного пробега 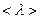 молекулы такого газа. Эффективный диаметр молекул водорода равен 027 нм.
молекулы такого газа. Эффективный диаметр молекул водорода равен 027 нм.
2.67 При нормальных условиях длина свободного пробега 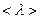 молекулы водорода равна 0,16 мкм. Определить диаметр d молекулы водорода.
молекулы водорода равна 0,16 мкм. Определить диаметр d молекулы водорода.
2.68 Какова средняя арифметическая скорость 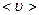 молекул кислорода, если известно, что средняя длина свободного пробега
молекул кислорода, если известно, что средняя длина свободного пробега 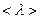 молекулы кислорода при этих условиях равна 100 нм?
молекулы кислорода при этих условиях равна 100 нм?
2.69 В сосуде вместимостью 5л находиться водород массой m = 0,5г. Определить среднюю длину свободного пробега 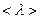 молекулы водорода в этом сосуде.
молекулы водорода в этом сосуде.
2.70 Средняя длина свободного пробегамолекулы водорода при некоторых условиях равна 2 мм. Найти плотность 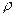 водорода при этих условиях.
водорода при этих условиях.
2.71 12 г газа занимают объем 4 ∙10 -3 м3 при температуре 7°С. После нагревания газа при постоянном давлении его плотность стала равна 6 ∙10 -4 г/см3. До какой температуры нагрели газ?
2.72 В сосуде находится смесь 10 г углекислого газа и 15 г азота. Найти плотность этой смеси при температуре 27°С и давлении 1,5 ∙105 Н/м2.
2.73 Определить молярную массусмеси кислорода массой m 1= 25 г и азота массой т 2= 75 г.
2.74 Определить среднюю кинетическую энергию поступательного движения молекул, содержащихся в 1г азота, и энергию вращательного движения молекул при температуре 300 К.
2.75 Средняя квадратичная скорость некоторого газа при нормальных условиях равна 480 м/с. Сколько молекул содержит 1г этого газа?
2.76 Определить наиболее вероятную скорость молекул газа, плотность которого при давлении 40 кПа составляет 0,35 кг/м3.
2.77 Определить среднюю кинетическую энергию поступательного движения молекул газа, находящегося под давлением 0,1 Па. Концентрация молекул газа равна 1013 см-3.
2.78 В баллоне вместимостью 10 дм3 находится гелий массой 2 г. Определить среднюю длину свободного пробега молекул гелия. Диаметр молекулы принять равным 0,19 нм.
2.79 Определить среднюю квадратичную скорость молекул аргона, находящегося под давлением 0,1 МПа, если известно, что средняя длина свободного пробега его молекул 0,1 мкм. Диаметр молекулы аргона принять равным 0,29 нм.
2.80 Во сколько раз средняя арифметическая скорость молекул воздуха в холодильной камере отличается от скорости молекул в дымокамере? Температура холодильника равна –38°С, а температура для копчения равна +24°С.
2.81 Найдите среднюю длину свободного пробега атомов гелия в условиях, когда плотность гелия 2,1·10-2 кг/м3.
2.82 При некоторых условиях средняя длина свободного пробега молекул газа равна 160 нм и средняя арифметическая скорость его молекул равна 1,95 км/с. Чему будет равно среднее
число столкновений в 1 с молекул этого газа, если при той же температуре давление газа уменьшить в 1,27 раза?
2.83 Коэффициенты диффузии и внутреннего трения водорода при некоторых условиях равны соответственно 1,42 см2/с и 8,5 мкПа∙с. Найдите число молекул водорода в 1 м3 при этих условиях.
2.84 При нормальных условиях длина свободного пробега молекулы водорода равна 0,16 мкм. Определить диаметр молекулы водорода.
2.85 Какова средняя арифметическая скорость молекул кислорода при нормальных условиях, если известно, что средняя
длина свободного пробега молекулы кислорода при этих условиях равна 100 нм?
2.86 Найти коэффициент диффузии водяного пара при нормальных условиях.
2.87 Для теплоизоляции скороморозильных камер используется пенополиуретан, эффективная теплопроводность которого 0,041 Вт/(м∙К). Определить суточный приток тепла через ограждения камеры, размеры которой 3,9  3,1
3,1 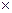 1,7 м3, если толщина слоя теплоизоляции 10 см, температура в камере равна −38 °С, наружная температура равна +18 °С.
1,7 м3, если толщина слоя теплоизоляции 10 см, температура в камере равна −38 °С, наружная температура равна +18 °С.
2.88 Определить коэффициент теплопроводности азота, находящегося в некотором объеме при температуре 280 К. Эффективный диаметр молекул азота принять равным 0,36 нм.
2.89 Пространство между двумя параллельными пластинами площадью 150 см2 каждая, находящимися на расстоянии 5 мм друг от друга, заполнено кислородом. Одна пластина поддерживается при температуре 17°С, другая - при температуре 27°С. Определить количество теплоты, прошедшее за 5 мин посредством теплопроводности от одной пластины к другой. Кислород находится при нормальных условиях. Эффективный диаметр молекул кислорода считать равным 0,36 нм.
2.90 Определить коэффициент диффузии кислорода при нормальных условиях. Эффективный диаметр молекул кислорода принять равным 0,36 нм.
2.91 Найти среднюю длину свободного пробега молекул гелия при давлении 101,3кПа и температуре 273 К, если вязкость гелия 13 мкПа∙с.
2.92 Определить градиент плотности углекислого газа в почве, если через площадь 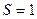 м2 ее поверхности за время
м2 ее поверхности за время 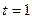 с в атмосферу прошел газ массой
с в атмосферу прошел газ массой 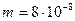 кг. Коэффициент диффузии
кг. Коэффициент диффузии 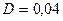 см2/с.
см2/с.
2.93 Определить толщину слоя суглинистой почвы, если за время 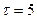 ч через площадь поверхности
ч через площадь поверхности 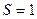 м2 проходит теплота
м2 проходит теплота 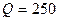 кДж. Температура на поверхности почвы
кДж. Температура на поверхности почвы 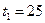 ºС, в нижнем слое почвы
ºС, в нижнем слое почвы 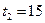 ºС.
ºС.
2.94 Сколько теплоты пройдет через площадь поверхности
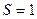 м2 песка за время
м2 песка за время 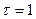 ч, если температура на его поверхности
ч, если температура на его поверхности 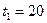 ºС, а на глубине
ºС, а на глубине 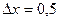 м –
м – 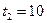 ºС?
ºС?
2.95 Определить массу газа, продиффундировавшего за 12 ч через поверхность почвы площадью 10 см2, если коэффициент диффузии 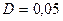 см2/с. Плотность газа на глубине 0,5м равна
см2/с. Плотность газа на глубине 0,5м равна 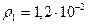 г/см3, а у поверхности
г/см3, а у поверхности 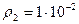 г/см3.
г/см3.
2.96 Определить коэффициент теплопроводности азота, находящегося в некотором объеме при температуре 280 К. Эффективный диаметр молекул азота принять равным 0,36 нм.
2.97 Кислород находится при нормальных условиях. Определить коэффициент теплопроводности кислорода, если эффективный диаметр его молекул равен 0,36 нм.
2.98 Пространство между двумя параллельными пластинами площадью 150 см2 каждая, находящимися на расстоянии 5 мм друг от друга, заполнено кислородом. Одна пластина поддерживается при температуре 17ºС, другая – при температуре 27ºС. Определить количество теплоты, прошедшее за 5 мин посредством теплопроводности от одной пластины к другой. Кислород находится при нормальных условиях. Эффективный диаметр молекул кислорода считать равным 0,36 нм.
2.99 Определить массу азота, прошедшего вследствие диффузии через площадку 50 см2 за 20 с, если градиент плотности в направлении, перпендикулярном площадке, равен 1 кг/м4, температура азота 290 К, а средняя длина свободного пробега его молекул равна 1 мкм.
2.100 Определить, во сколько раз отличаются коэффициенты динамической вязкости углекислого газа и азота, если оба газа находятся при одинаковых температуре и давлении. Эффективные диаметры молекул этих газов считать равными.
2.101 Азот находится под давлением 100 кПа при температуре 290 К. Определить коэффициенты диффузии и внутреннего трения. Эффективный диаметр молекул азота равен 0,38 нм.
2.102 Найти среднюю длину свободного пробега молекул гелия при давлении 101,3 кПа и температуре 273 К, если вязкость гелия 13 мкПа·с.
2.103 В сосуде объемом 2 л находится 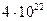 молекул двухатомного газа. Теплопроводность газа 14 мВт/(м ·К). Найти коэффициент диффузии газа.
молекул двухатомного газа. Теплопроводность газа 14 мВт/(м ·К). Найти коэффициент диффузии газа.
2.104 Свинцовая пуля, летевшая со скоростью 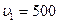 м/с, пробила стенку. Определить, на сколько градусов нагрелась пуля, если после стенки скорость ее снизилась до
м/с, пробила стенку. Определить, на сколько градусов нагрелась пуля, если после стенки скорость ее снизилась до 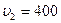 м/с. Считать, что на нагревание пули пошло 50% выделившейся теплоты.
м/с. Считать, что на нагревание пули пошло 50% выделившейся теплоты.
2.105 С какой скоростью должна лететь свинцовая пуля, чтобы при ударе о препятствие она расплавилась? Первоначальная температура пули равна 27ºС. Считать, что вся выделившаяся теплота сообщается пуле.
2.106 Какое количество теплоты нужно сообщить 1 кмоль кислорода, чтобы он совершил работу в 1000 Дж: а) при изотермическом процессе; б) при изобарном?
2.107 Определить количество теплоты,которое надо сообщить кислороду объемом 50 л при его изохорном нагревании, чтобы давление газа повысилось на 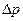 = 0,5 МПа.
= 0,5 МПа.
2.108 При изотермическом расширении азота при температуре 280 К объем его увеличился в два раза. Определить: 1) совершенную при расширении газа работу А; 2) изменение внутренней энергии; 3) количество теплоты, полученное газом. Масса азота m = 0,2 кг.
2.109 Кислород массой m = 200 г занимает объем V 1 = 100 л и находится под давлением р 1 = 200 кПа. При нагревании газ расширился при постоянном давлении до объема V 2 = 300 л, а затем его давление возросло до р 3= 500 кПа при неизменном объеме. Найти изменение внутренней энергии 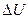 газа, совершенную газом работу A и теплоту Q, переданную газу. Построить график процесса.
газа, совершенную газом работу A и теплоту Q, переданную газу. Построить график процесса.
2.110 Объем водорода при изотермическом расширении при температуре 300 К увеличился в n = 3 раза. Определить работу А, совершенную газом, и теплоту Q, полученную при этом. Масса т водорода равна 200 г.
2.111 Азот массой 0,l кг был изобарно нагрет от температуры 200 К до температуры 400 К. Определить работу А, совершенную газом, полученную им теплоту Q и изменение 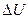 внутренней энергии азота.
внутренней энергии азота.
2.112 Во сколько раз увеличится объем водорода, содержащий количество вещества 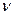 = 0,4 мoль при изотермическом расширении, если при этом газ получит количество теплоты Q = 800 Дж? Температура водорода T = 300 K.
= 0,4 мoль при изотермическом расширении, если при этом газ получит количество теплоты Q = 800 Дж? Температура водорода T = 300 K.
2.113 Какая работа A совершается при изотермическом расширении водорода массой 5 г, взятого при температуре 290 К, если объем газа увеличивается в три раза?
2.114 Вычислите отношение теплоемкостей (Ср/СV) для смеси 3 моль аргона и 5 моль кислорода.
2.115 Определите показатель адиабаты 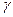 для смеси газов, содержащей гелий массой 8 г и водород массой 2 г. Газы считать идеальными.
для смеси газов, содержащей гелий массой 8 г и водород массой 2 г. Газы считать идеальными.
2.116 Расширяясь, 1 моль водорода совершил работу, равную 10 Дж. Какое количество теплоты было подведено к газу, если газ расширялся: а) изобарно; б) изотермически?
2.117 Одноатомный газ занимает объем 4 м3 и находится под давлением 8∙105 Па. После изотермического расширения этого газа установилось давление 1 атм. Определить: а) работу, совершаемую газом при расширении; б) какое количество теплоты было поглощено газом в процессе расширения; в) на сколько изменилась при этом внутренняя энергия газа.
2.118 Некоторая масса азота при давлении 1∙105 Па имела объем 5 л, а при давлении 3∙105 Па – объем 2 л. Переход из первого состояния во второе был совершен в два этапа:
а) сначала по изохоре, затем по изобape; б) сначала по изобаре, затем по изохоре. Определить изменение внутренней энергии, количество отданной или полученной теплоты и произведенную работу в обоих случаях. Почему результаты для рассмотренных двух переходов различны?
2.119 При изобарическом расширении 1 моль некоторого газа, занимавшего объем 12 л при давлении 2·105 Па, было
подведено к газу 2750 Дж теплоты, при этом газ совершил работу 1100 Дж. Определить: а) параметры газа в конечном состоянии; б) из какого числа атомов состоят молекулы газа.
2.120 За счет 1 кДж теплоты, получаемого от нагревателя, машина, работающая по циклу Карно, совершает работу 0,5кДж. Температура нагревателя 500 К. Определить температуру холодильника.
2.121 Найти КПД цикла, состоящего из двух изобар и двух адиабат, если температуры характерных точек равны 370 К, 600 К, 500 К, 350 К. Решение пояснить диаграммой p −V.
2.122 Идеальный газ совершает цикл Карно при температурах холодильника 290 К и нагревателя 400 К. Во сколько раз увеличится коэффициент полезного действия цикла, если температура нагревателя возрастет до 600 К?
2.123 Идеальный газ совершает цикл Карно. Температура нагревателя в четыре раза больше температуры холодильника. Какую долю количества теплоты, полученного за один цикл от
нагревателя, газ отдаст холодильнику?
2.124 Идеальный газ совершает цикл Карно при температурах теплоприемника Т 2= 290 К и теплоотдатчика Т 1 = 400 K. Во сколько раз увеличится коэффициент полезного действия 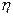 цикла, если температура теплоотдатчика возрастет до 600К?
цикла, если температура теплоотдатчика возрастет до 600К?
2.125 Газ, совершающий цикл Карно, отдал теплоприемнику теплоту 14 кДж. Определить температуру T 1 теплоотдатчика, если при температуре теплоприемника T 2 = 280 К работа цикла A = 6 кДж.
2.126 Газ, являясь рабочим веществом в цикле Карно, получил от теплоотдатчика теплоту Q 1 = 4,38 кДж и совершил работу A = 2,4 кДж. Определить температуру теплоотдатчика, если температура теплоприемника T 2 = 273 К.
2.127 Определить изменение энтропии, происходящее при смешивании 5 кг воды, находящейся при температуре 280 К, и
8 кг воды, находящейся при температуре 350 К.
2.128 Как изменится энтропия при изотермическом расширении 0,1 кг кислорода, если при этом объем его изменится от
2,5 л до 10 л?
2.129 В процессе политропного расширения воздуха к нему было подведено 90 кДж тепла, и все же его температура снизилась от 25°С до – 37°С. Масса воздуха 4 кг, начальное давление воздуха 4·105 Па. Определить изменение энтропии в этом процессе.
2.130 Найдите изменение энтропии 1 кг воздуха, если его давление увеличилось от 2∙105 Па до 1∙106 Па, а температура понизилась от 327°С до 127°С.
2.131 Найти изменение энтропии при переходе массы 8 г кислорода от объема 10 л при температуре 80°С к объему 40 л
при температуре 300 °С.
2.132 Найти изменение энтропии при изобарном сжатии массы 8,0 г гелия от объема 25 л до объема 10 л.
2.133 Найти изменение энтропии при изотермическом расширении массы 5 г водорода от давления 100 кПа до давления
50 кПа.
2.134 Углекислый газ массой 88 г занимает при температуре 290К объём 1000 см3. Рассчитайте его внутреннюю энергию, если 1) газ идеальный, 2) газ реальный. Для углекислого газа температура Tкр . = 304 К, критическое давление pкр .= 7, 39 МПа.
2.135 Найти критические параметры неона, если считать известными его постоянные в уравнении Ван-дер-Ваальса.
2.136 Азот массой 14 кг занимает объем 0,5 м3 при температуре 0°С. Пользуясь уравнением Ван-дер-Ваальса, найти, на сколько нужно изменить температуру газа, чтобы его давление увеличилось вдвое.
2.137 В сосуде, объем которого 10 л, находится 360 г водяного пара при температуре 470 К. Вычислить давление пара, используя уравнение Ван-дер-Ваальса.
2.138 Определить эффективный диаметр молекулы газа, для которого критическая температура равна 282,7 К, поправка в уравнении Ван-дер-Ваальса a = 45,3 ·10-2 Н∙м4/моль2.
2.139 Найти эффективный диаметр молекулы кислорода, считая известными для кислорода критические значения температуры и давления.
2.140 Найти эффективный диаметр молекулы азота двумя способами: а) по данному значению средней длины свободного
пробега молекул при нормальных условиях 95 нм; б) по известному значению постоянной b в уравнении Ван-дер-Ваальса.
2.141 По уравнению Ван-дер-Ваальса определить давление, под которым находится 1 кмоль азота в сосуде объемом 2,5 м3, если его температура 310 К.
2.142 Найти постоянные в уравнении Ван-дер-Ваальса для углекислого газа, считая известными его критическую температуру и критическое давление.
2.143 Давление кислорода, имеющего плотность 100 кг/м3, составляет 7·106 Па. Определить внутреннее давление (давление, обусловленное взаимодействием молекул) и температуру газа, пользуясь уравнениями Ван-дер-Ваальса и Менделеева-Клапейрона.
2.144 В сосуде объемом 8 л находится 0,3 кг кислорода при температуре 37°С. Какую часть давления газа составляет давление, обусловленное силами притяжения молекул? Какую часть объема сосуда составляет собственный объем молекул?
2.145 При каком давлении должен находиться кислород в количестве 0,1 кмоль, чтобы при температуре 320 К он занимал
объем 0,1м3? Задачу решить, рассматривая кислород: а) как идеальный газ; б) как реальный газ. Поправки в уравнении Ван-дер-Ваальса для кислорода считать известными.
2.146 В сосуде содержится 1 моль газа. Его давление в 20 раз больше критического давления, а объем равен половине критического объема. Определить отношение температуры этого газа к критической температуре.
2.147 Найти добавочное давление р внутри мыльного пузыря диаметром 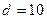 см и определить работу А, которую нужно совершить, чтобы выдуть этот пузырь. Поверхностное натяжение мыльной воды
см и определить работу А, которую нужно совершить, чтобы выдуть этот пузырь. Поверхностное натяжение мыльной воды 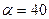 мН/м.
мН/м.
2.148 Определить изменение свободной энергии 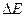 поверхности мыльного пузыря при изобарическом увеличении его объема от
поверхности мыльного пузыря при изобарическом увеличении его объема от 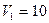 см3 до
см3 до 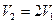 . Поверхностное натяжение мыльного раствора
. Поверхностное натяжение мыльного раствора 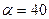 мН/м.
мН/м.
2.149 Из вертикальной трубки внутренним радиусом 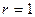 мм вытекают капли воды. Найти радиус капли в момент отрыва. Каплю считать сферической. Диаметр шейки капли в момент отрыва считать равным внутреннему диаметру трубки. Плотность
мм вытекают капли воды. Найти радиус капли в момент отрыва. Каплю считать сферической. Диаметр шейки капли в момент отрыва считать равным внутреннему диаметру трубки. Плотность 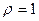 г/см3, поверхностное натяжение
г/см3, поверхностное натяжение 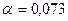 Н/м.
Н/м.
2.150 На сколько нагреется капля ртути, полученная от слияния двух капель радиусом 1 мм каждая? Плотность ртути 13,6 г/см3, поверхностное натяжение 0,5 Н/м, удельная теплоемкость 138 Дж/(кг · К).
2.151 Какую работу против сил поверхностного натяжения надо совершить, чтобы разбить сферическую каплю ртути радиусом 3 мм на две одинаковые капли? Поверхностное натяжение ртути принять равным 0,5 Н/м.
2.152 Какую работу против сил поверхностного натяжения надо совершить, чтобы увеличить вдвое объем мыльного пузыря радиусом 1 см? Коэффициент поверхностного натяжения мыльного раствора принять равным 0,043 Н/м.
2.153 Давление воздуха внутри мыльного пузыря на 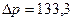 Па больше атмосферного. Чему равен диаметр пузыря? Поверхностное натяжение мыльного раствора принять равным 0,043 Н/м.
Па больше атмосферного. Чему равен диаметр пузыря? Поверхностное натяжение мыльного раствора принять равным 0,043 Н/м.
2.154 Какую работу надо совершить при выдувании мыльного пузыря, чтобы увеличить его объем от 8 см3 до 16 см3? Считать процесс изотермическим.
2.155 Глицерин поднялся в капиллярной трубке диаметром канала 1 мм на высоту 20 мм. Определить коэффициент поверхностного натяжения глицерина. Считать смачивание полным.
2.156 В воду опущена на очень малую глубину стеклянная трубка с диаметром канала 1 мм. Определить массу воды, вошедшей в трубку.
2.157 В сосуд с ртутью опущен открытый капилляр, внутренний диаметр которого 3 мм. Разность уровней ртути в сосуде и капилляре 3,7 мм. Чему равен радиус кривизны ртутного мениска в капилляре?
2.158 В сосуд с ртутью опущен открытый капилляр, внутренний диаметр которого 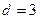 мм. Разность уровней ртути в сосуде и в капилляре
мм. Разность уровней ртути в сосуде и в капилляре 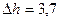 мм. Чему равен радиус кривизны ртутного мениска в капилляре? Плотность ртути 13,6 г/см3, поверхностное натяжение 0,5 Н/м.
мм. Чему равен радиус кривизны ртутного мениска в капилляре? Плотность ртути 13,6 г/см3, поверхностное натяжение 0,5 Н/м.
2.159 На какую высоту поднимется бензол в капилляре, внутренний диаметр которого равен 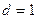 мм? Смачивание считать полным. Плотность бензола и его поверхностное натяжение соответственно равны 0,88 г/см3 и 0,03 Н/м.
мм? Смачивание считать полным. Плотность бензола и его поверхностное натяжение соответственно равны 0,88 г/см3 и 0,03 Н/м.
2.160 Какую силу надо приложить, чтобы оторвать друг от друга (без сдвига) две смоченные фотопластинки размером 9×12 см? Толщину водяной прослойки между пластинками считать равной 0,05 мм. Смачивание полное. Поверхностное натяжение воды принять равным 0,073 Н/м.
2.161 Между двумя вертикальными плоскопараллельными стеклянными пластинками, находящимися на расстоянии 0,25 мм друг от друга, налита жидкость. Найти плотность жидкости, если известно, что высота поднятия жидкости между пластинками равна 3,1 см. Поверхностное натяжение жидкости равно 0,03 Н/м. Смачивание полное.
2.162 Найти массу m воды, вошедшей в стеклянную трубку с диаметром канала d = 0,8 мм, опущенную в воду на малую глубину. Считать смачивание полным.
 2015-01-07
2015-01-07 2934
2934








