












|
 Zn
Zn 









|
 Cu
Cu
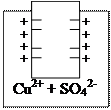 |
Zn/ZnSO4 Cu/CuSO4
Zn0 - 2ē ↔ Zn2+ (1) Cu0 - 2ē ↔ Cu2+ (2)
В обоих полуэлементах образуются электродные потенциалы, однако на цинке будет больший избыток электронов, т.к. он более активный металл, поэтому равновесие (1) в большей степени смещено вправо, чем равновесие (2).
Для замыкания цепи необходимы:
Проводник первого рода – металлическая проволока (для движения электронов по внешней цепи)
Проводник второго рода – стеклянная трубка, заполненная агар-агаром и KCl (электролитический мостик, по которому движутся анионы).
 После замыкания цепи
После замыкания цепи
ē




|








|
 | |||||
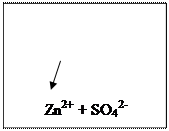 |
|
SO42-
 | |||||||
 |  | ||||||
 | |||||||
ē


 _
_
(А) Zn / ZnSO4 // CuSO4 / Cu (K)
Равновесие (1) и (2) нарушаются:
 |  |
(1) (А) Zn0 - 2ē → Zn2+ (K) Cu2+ + 2ē → Cu0
Выводы:
 Анод – электрод, на котором Катод – электрод, на котором
Анод – электрод, на котором Катод – электрод, на котором
происходит процесс окисления; происходит процесс восстановления;
• активный металл (φ<); • неактивный металл (φ>);


 • заряд, т.к. ионы Ме+n из метал – • заряд, т.к. ионы Меn+ переходят из
• заряд, т.к. ионы Ме+n из метал – • заряд, т.к. ионы Меn+ переходят из
лической кристаллической решётки раствора на электрод;
переходят в раствор;
• процесс Ме0 – nē → Men+ - • процесс Меn+ + nē → Ме0 - за счёт (ē),
избыток (ē) на (А). которые перешли с анода.
 | |||||||||
 |  |  |  | ||||||




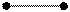






 ●
● 

 ● ●
● ●


 ●
● 

 |  | ||||
 |
 Расчёт ЭДС (Г.Э.)
Расчёт ЭДС (Г.Э.)
ЭДС (электродвижущая сила) – разность потенциалов.
ЭДС = φ(К) – φ(А)
Стандартные условия: ЭДС = φ0Сu2+/Cu0 – φ0Zn2+/Zn0 = 0,34 – (- 0,76) = 1,1 В.
Для произвольных условий - по уравнению Нернста:
ЭДС = (φ0Сu2+/Cu0 + 2,31·R·T lg[Cu2+]) – (φ0Zn2+/Zn0 + 2,31·R·T lg[Zn2+])
n·F n·F
ЭДС = (φ0Сu2+/Cu0 + 0,059/2·lg[Cu2+]) – (φ0Zn2+/Zn0 + 0,059/2·lg[Zn2+])
РЕШЕНИЕ ТИПОВОЙ ЗАДАЧИ ПО ТЕМЕ: «ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ»
Задача
Рассмотрите работу гальванического элемента: Cu/CuCl2//CdCl2/Cd.
[Cu2+] = 0,1 M; [Cd2+] = 0,001 M
1. φрСu2+/Cu0 = φ0Сu2+/Cu0 + 0,059/2·lg[Cu2+] = 0,34 + 0,059/2·lg10-1 = 0,3103 В
φрСd2+/Cd0 = φ0Сd2+/Cd0 + 0,059/2·lg[Cd2+] = - 0,4 + 0,059/2·lg10-3 = - 0,4885 B
2. φрСu2+/Cu0 > φрСd2+/Cd0 => Cd – (A), Cu – (K).
ē

 3.
3. 
 _
_
(A) Cd/ CdCl2// CuCl2/ Cu (K)
4. ē
|




|







 5. (A) Cd Cu (K)
5. (A) Cd Cu (K)
 | |||||
 | |||||
Cl-
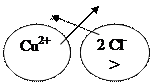 | |||||
 |  | ||||
6. 

(А) Cd0 - 2ē → Cd2+
 |
(K) Cu2+ + 2ē → Cu0
7. ЭДС = φ(К) – φ(А) = 0,3103 – (-0,4885) = 0,7988 В
 2015-01-07
2015-01-07 605
605








