Различают необратимые реакции нулевого, первого, второго и третьего порядков:
1) нулевого порядка: 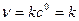 , т.е. скорость химической реакции не зависит от концентрации реагирующих веществ;
, т.е. скорость химической реакции не зависит от концентрации реагирующих веществ;
2) первого порядка n = 1: А ® Продукты 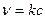 ;
;
3) второго порядка n = 2: А + В ® Продукты 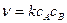 ,
,
2А ® Продукты (с = с А) 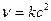 ;
;
4) третьего порядка n = 3: А + В + D ® Продукты 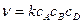 ,
,
2А + B ® Продукты (с = с А) 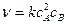 ,
,
3A ® Продукты (с = с А) 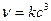
Эти формулы справедливы для необратимых или односторонних реакций, проходящих до полного исчезновения исходных веществ.
Если молекулярность определяет фактическое число частиц, участвующих в элементарном акте химического взаимодействия, то порядок реакции – формальное понятие, находимое из кинетических уравнений химических реакций. Молекулярность и порядок реакции совпадают только для простых реакций, протекающих в одну элементарную стадию без участия посторонних молекул. Молекулярность и порядок не совпадают в трех случаях: для сложных реакций, для гетерогенных реакций и реакций с избытком одного из реагирующих веществ.
|
|
|
Формальная кинетика дает возможность находить константы скорости и изменение концентрации реагирующих веществ.
Для скорости реакции 0-го порядка: 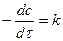 ,
, 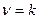 . Интегрируя, получим:
. Интегрируя, получим: 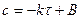 , где В – постоянная интегрирования. При t = 0 и с = 0 В = с0, тогда
, где В – постоянная интегрирования. При t = 0 и с = 0 В = с0, тогда 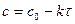 , где с 0 – концентрация исходного вещества.
, где с 0 – концентрация исходного вещества.
Время t1/2, в течение которого первоначальная концентрация исходного вещества снижается наполовину (с = с 0/2), называют временем (периодом) полупревращения.
Для реакции нулевого порядка 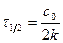 ,
, 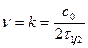 .
.
Для реакции первого порядка: 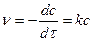 . Разделив переменные
. Разделив переменные 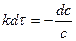 , проинтегрируем:
, проинтегрируем: 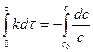 , получим:
, получим: 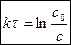 ,
, 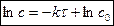 ,
, 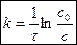
Для с = 0,5 с 0 имеем: 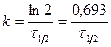 или
или 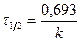
Так как в кинетическое уравнение реакции 1-го порядка входит отношение исходной с0 и текущей с концентраций, можно пользоваться не абсолютными концентрациями, а относительными величинами (процентным содержанием прореагировавшего вещества и др.).
Для простой (элементарной) реакции 2-го порядка в случае реагирования одинаковых частиц и с 1 = с 2 = с кинетическое уравнение: 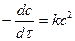 . Разделив переменные:
. Разделив переменные: 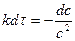 и проинтегрировав:
и проинтегрировав: 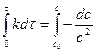 , получим:
, получим:
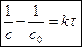 ,
, 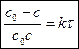 .
.
Время полупревращения: 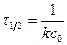 ; константа
; константа 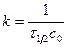 .
.
Если в элементарном акте реакции 2-го порядка реагируют два различных вещества и с0,1 ¹ с0,2, то 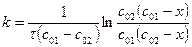 .
.
Для элементарной реакции 3-го порядка в случае одинаковых реагирующих веществ и с 1 = с 2 = с 3 = с кинетическое уравнение:
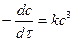 ;
; 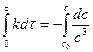 ;
; 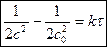 ;
; 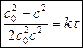
Время полупревращения: 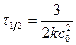 ; константа
; константа 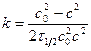 .
.
Полученные кинетические уравнения устанавливают связь между параметрами течения химической реакции (k, c0, c, t), когда порядок реакции известен. В противном случае его нужно определить.
 2014-05-17
2014-05-17 5082
5082
