Свойства реальных газов не только в количественном, но и в качественном отношении отличаются от свойств реальных газов. Теория идеальных газов не может объяснить фазовые превращения газа и жидкости, она не может установить границы области фазовых переходов, параметры критического состояния.
В 1869 г. английский физик Эндрюс впервые на основании проведенных им экспериментов по изотермическому сжатию СО2 построил pv -диаграмму для реального газа и показал на ней характерные граничные линии и области состояний.
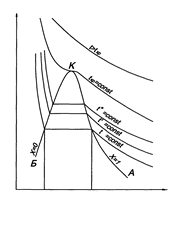
| Рис.2. pv -диаграмма реальных газов | |
Ранее было известно, что одни газы путем сжатия при комнатной температуре удается перевести в жидкое состояние, другие - нет. Не было объяснения этому явлению.
Проследить за поведением газа в процессе изотермического (
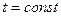
) сжатия можно по
pv -диаграмме, рис. 2. Участок 1-2 кривой сжатия соответствует изменению параметров
p и
v газообразного состояния вещества. В точке 2 давление газа достигает величины
рн – давления насыщения при данной температуре
t и газ начинает конденсироваться при
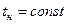
и
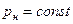
, процесс 2-3.
В точке 3 процесс конденсации завершается.
Кривая 3-4 соответствует процессу сжатия жидкой фазы при 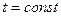 . Поскольку жидкость плохо сжимается, объем здесь меняется мало, а давление резко возрастает.
. Поскольку жидкость плохо сжимается, объем здесь меняется мало, а давление резко возрастает.
Исследуя зависимость v от р на разных изотермах t, t’, t” и т.д., Эндрюс установил, что чем выше температура, тем меньше разница между удельными объемами сухого насыщенного пара 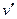 и насыщенной жидкости
и насыщенной жидкости 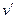 . С повышением температуры
. С повышением температуры 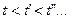 точки 2,
точки 2, 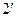 ,
, 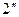 …, образующие верхнюю пограничную кривую АК (линия сухого насыщенного пара, x = 1), сближаются соответственно с точками 3,
…, образующие верхнюю пограничную кривую АК (линия сухого насыщенного пара, x = 1), сближаются соответственно с точками 3, 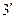 ,
, 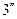 …, образующими нижнюю пограничную кривую БК (линия кипящей жидкости, х = 0). Здесь х – степень сухости,
…, образующими нижнюю пограничную кривую БК (линия кипящей жидкости, х = 0). Здесь х – степень сухости,
х = 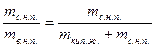 ,
,
где 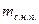 - масса сухого насыщенного пара,
- масса сухого насыщенного пара,
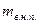 - масса влажного насыщенного пара – смеси кипящей жидкости и сухого насыщенного пара.
- масса влажного насыщенного пара – смеси кипящей жидкости и сухого насыщенного пара.
Разность удельных объемов 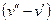 уменьшается до тех пор, пока при некоторой температуре tкр не станет равной нулю, т.е.
уменьшается до тех пор, пока при некоторой температуре tкр не станет равной нулю, т.е. 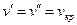 . Состояние в точке К с параметрами ркр, vкр и tкр назвали критическим. В этой точке исчезают различия между жидкой и газовой фазами.
. Состояние в точке К с параметрами ркр, vкр и tкр назвали критическим. В этой точке исчезают различия между жидкой и газовой фазами.
Таким образом, для реального газа в pv -диаграмме можно выделить три характерные области:
· область жидкого состояния – расположена левее кривой х = 0 (БК), 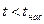 ;
;
· область двухфазных состояний – влажного насыщенного пара, расположенную между линиями х = 0 и х = 1 (между БК и АК), 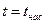 ;
;
· область перегретого пара, расположенную правее кривой х = 1 (АК), 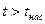 .
.
Нетрудно видеть, что при 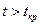 путем простого изотермического сжатия попасть в область фазовых переходов нельзя. Этим объясняется то, что газы, у которых
путем простого изотермического сжатия попасть в область фазовых переходов нельзя. Этим объясняется то, что газы, у которых 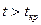 , без понижения температуры не переходят в жидкое состояние.
, без понижения температуры не переходят в жидкое состояние.
В таблице 1 приведены критические параметры некоторых реальных газов.
Таблица 1
| Параметры | Н2 | N2 | CO2 | O2 | H2O | Hg |
| tкр ., °С | -239,9 | -147,0 | 31,05 | 118,4 | 374,15 | |
| ркр ., МПа | 1,293 | 3,39 | 7,837 | 5,07 | 22,13 | 147,0 |
| vкр ., м3/кг | 0,0323 | 0,00322 | 0,002137 | 0,00233 | 0,00326 | - |
Вещество в критическом состоянии имеет ряд особенностей. Критическая изотерма tкр . в критической точке К имеет горизонтальную касательную и перегиб, т.е.
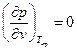 и
и 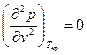 . (7)
. (7)
Вблизи этой точки наблюдается скачек теплоемкости 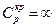 . В точке К теплота парообразования
. В точке К теплота парообразования 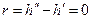 , становятся равными нулю силы поверхностного натяжения
, становятся равными нулю силы поверхностного натяжения 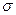 , которые являются наиболее ярким проявлением межмолекулярного взаимодействия. Поэтому в этой точке отсутствует межфазная поверхность, здесь наблюдается высокая растворяющая способность вещества.
, которые являются наиболее ярким проявлением межмолекулярного взаимодействия. Поэтому в этой точке отсутствует межфазная поверхность, здесь наблюдается высокая растворяющая способность вещества.
Особые свойства веществ в критической и околокритической областях состояния в настоящее время уже находят применение в пищевой, фармацевтической, парфюмерной, химической, нефте- и углеперерабатывающей отраслях промышленности, в решении экологических проблем. В частности, «предложено использование суб- и сверхкритических флюидов в роли экстрагентов и растворителей в процессах выделения, разделения, очистки и фракционирования» /3/. При этом решаются проблемы создания перспективных энергосберегающих и малоотходных технологий.

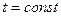 ) сжатия можно по pv -диаграмме, рис. 2. Участок 1-2 кривой сжатия соответствует изменению параметров p и v газообразного состояния вещества. В точке 2 давление газа достигает величины рн – давления насыщения при данной температуре t и газ начинает конденсироваться при
) сжатия можно по pv -диаграмме, рис. 2. Участок 1-2 кривой сжатия соответствует изменению параметров p и v газообразного состояния вещества. В точке 2 давление газа достигает величины рн – давления насыщения при данной температуре t и газ начинает конденсироваться при 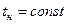 и
и 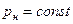 , процесс 2-3.
, процесс 2-3. 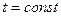 . Поскольку жидкость плохо сжимается, объем здесь меняется мало, а давление резко возрастает.
. Поскольку жидкость плохо сжимается, объем здесь меняется мало, а давление резко возрастает.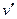 и насыщенной жидкости
и насыщенной жидкости 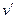 . С повышением температуры
. С повышением температуры 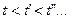 точки 2,
точки 2, 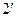 ,
, 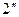 …, образующие верхнюю пограничную кривую АК (линия сухого насыщенного пара, x = 1), сближаются соответственно с точками 3,
…, образующие верхнюю пограничную кривую АК (линия сухого насыщенного пара, x = 1), сближаются соответственно с точками 3, 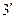 ,
, 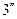 …, образующими нижнюю пограничную кривую БК (линия кипящей жидкости, х = 0). Здесь х – степень сухости,
…, образующими нижнюю пограничную кривую БК (линия кипящей жидкости, х = 0). Здесь х – степень сухости,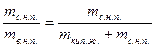 ,
,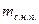 - масса сухого насыщенного пара,
- масса сухого насыщенного пара,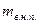 - масса влажного насыщенного пара – смеси кипящей жидкости и сухого насыщенного пара.
- масса влажного насыщенного пара – смеси кипящей жидкости и сухого насыщенного пара.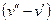 уменьшается до тех пор, пока при некоторой температуре tкр не станет равной нулю, т.е.
уменьшается до тех пор, пока при некоторой температуре tкр не станет равной нулю, т.е. 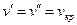 . Состояние в точке К с параметрами ркр, vкр и tкр назвали критическим. В этой точке исчезают различия между жидкой и газовой фазами.
. Состояние в точке К с параметрами ркр, vкр и tкр назвали критическим. В этой точке исчезают различия между жидкой и газовой фазами.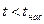 ;
;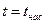 ;
;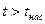 .
.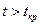 путем простого изотермического сжатия попасть в область фазовых переходов нельзя. Этим объясняется то, что газы, у которых
путем простого изотермического сжатия попасть в область фазовых переходов нельзя. Этим объясняется то, что газы, у которых 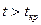 , без понижения температуры не переходят в жидкое состояние.
, без понижения температуры не переходят в жидкое состояние.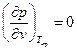 и
и 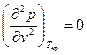 . (7)
. (7)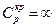 . В точке К теплота парообразования
. В точке К теплота парообразования 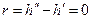 , становятся равными нулю силы поверхностного натяжения
, становятся равными нулю силы поверхностного натяжения  , которые являются наиболее ярким проявлением межмолекулярного взаимодействия. Поэтому в этой точке отсутствует межфазная поверхность, здесь наблюдается высокая растворяющая способность вещества.
, которые являются наиболее ярким проявлением межмолекулярного взаимодействия. Поэтому в этой точке отсутствует межфазная поверхность, здесь наблюдается высокая растворяющая способность вещества. 2015-02-24
2015-02-24 3122
3122








