Все вещества состоят из атомов. Атомы состоят из элементарных частиц. Атом – система взаимодействующих элементарных частиц, состоящая из ядра и электронов. Тип атома определяется составом его ядра. Элемент – совокупность атомов с одинаковым зарядом ядра.
Квантовая механика основывается на представлении о том, что энергия распространяется и передается, поглощается и испускается не непрерывно, а дискретно, отдельными порциями – квантами.
В основе современной теории строения атома лежат следующие основные положения:
1. Электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя и как частица, и как волна: подобно частице, электрон обладает определенной массой и зарядом; в то же время, движущийся электрон проявляет волновые свойства, например характеризуется способностью к дифракции.
Уравнение, описывающее одновременно волновые и корпускулярные свойства фотонов, можно вывести, сопоставив уравнение Планка 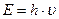 с уравнением Эйнштейна
с уравнением Эйнштейна 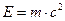 . Отсюда,
. Отсюда, 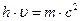 ,
, 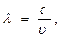 окончательно имеем
окончательно имеем 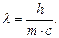 Согласно этому уравнению, фотону, имеющему массу m и движущемуся со скоростью c, соответствует волна длиной l. Длина волны электрона l и его скорость u связаны соотношением де Бройля:
Согласно этому уравнению, фотону, имеющему массу m и движущемуся со скоростью c, соответствует волна длиной l. Длина волны электрона l и его скорость u связаны соотношением де Бройля:
|
|
|
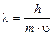 ,
,
где m – масса электрона; 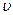 - частота излучения; h – универсальная постоянная, называемая постоянной Планка, равной 6,63 × 10-34 Дж × с.
- частота излучения; h – универсальная постоянная, называемая постоянной Планка, равной 6,63 × 10-34 Дж × с.
Для электрона невозможно одновременно точно измерить координату и скорость. Чем точнее измеряется скорость, тем больше неопределенность в координате, и наоборот. Математическим выражением принципа неопределенности служит соотношение
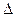
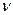 ·
· 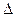 x >
x > 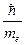 ,
,
где 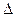 x – неопределенность положения координаты,
x – неопределенность положения координаты, 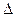
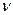 - погрешность измерения скорости,
- погрешность измерения скорости, 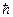 =
= 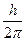 - квант момента количества движения.
- квант момента количества движения.
Электрон может находиться в любой точке вблизи ядра атома, но вероятность его пребывания в различных атомах неодинакова. Вероятное нахождение электрона в определенном положении в любой момент времени соответствует принципу неопределенности Гейзенберга.
Поскольку движение электрона в атоме имеет волновой характер, квантовая механика описывает это движение при помощи волновой функции 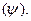 Физический смысл волновой функции
Физический смысл волновой функции 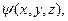 таков, что квадрат абсолютного значения волновой функции
таков, что квадрат абсолютного значения волновой функции 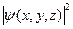 пропорционален вероятности нахождения электрона в какой-либо точке пространства с координатами
пропорционален вероятности нахождения электрона в какой-либо точке пространства с координатами 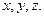
Волновое уравнение Э. Шредингера - уравнение стоячей электромагнитной волны:
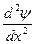 +
+ 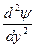 +
+ 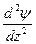 +
+ 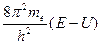 = 0,
= 0,
где E - полная; U - потенциальная энергия электрона; me - масса электрона; h - постоянная Планка; 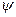 - волновая функция (пси-функция), количественно характеризующая амплитуду движения электрона с координатами х, у, и z как трехмерной электромагнитной волны.
- волновая функция (пси-функция), количественно характеризующая амплитуду движения электрона с координатами х, у, и z как трехмерной электромагнитной волны.
|
|
|
2. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части околоядерного пространства, но вероятность его нахождения в разных частях этого пространства неодинакова. Пространство вокруг ядра, в котором вероятность нахождения электрона достаточна велика, называется орбиталью.
 Область пространства, для которой вероятность найти электрон составляет 95%, называется атомной орбиталью (АО) и обозначают или. Заполненные одним или двумя электронами АО обозначают соответственно:
Область пространства, для которой вероятность найти электрон составляет 95%, называется атомной орбиталью (АО) и обозначают или. Заполненные одним или двумя электронами АО обозначают соответственно:
 |
3. Ядра атомов состоят из протонов и нейтронов (общее название нуклонов). Число протонов (Z) в ядре равно порядковому номеру элемента в периодической системе, а сумма чисел протонов и нейтронов (N) соответствует его массовому числу (А):
Z = A – N, N = A – Z, A = Z + N
В ядрах атомов одного и того же элемента может содержаться при одинаковом числе протонов разное число нейтронов. Такие атомы имеют различную массу, но одинаковый заряд ядра и, следовательно, одинаковое число электронов.
Атомы с одинаковыми значениями Z, но разными: А и N (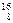 O,
O, 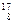 O,
O, 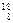 O) называются изотопами, с одинаковыми N, но разными А и Z – изотонами, с одинаковыми А, но разными Z и N – изобарами. Химические свойства всех изотопов одного элемента одинаковы.
O) называются изотопами, с одинаковыми N, но разными А и Z – изотонами, с одинаковыми А, но разными Z и N – изобарами. Химические свойства всех изотопов одного элемента одинаковы.
Устойчивому состоянию ядер атомов соответствуют определенные соотношения чисел протонов и нейтронов. При нарушении устойчивого протонно-нейтронного соотношения ядро становится радиоактивным. Радиоактивностью называется самопроизвольное превращение неустойчивых атомных ядер в другие ядра.
В химических реакциях ядра атомов неизменны, меняются лишь электронные оболочки атомов. Эти изменения определяются запасом энергии и числом электронов атома.
Основные характеристики электрона в атоме - энергия, форма и ориентация электронного облакаотносительно внешнего магнитного поля атома, которые определяются квантовыми числами.
Главное квантовое число (n) определяет общую энергию электрона на данной орбитали или его энергетический уровень. Оно определяет размеры атомной орбитали и может принимать любые целые значения от 1 до ¥: (n = 1, 2, 3,…, ¥). Под главным квантовым числом, равным ¥, подразумевается, что электрону сообщена энергия, достаточная для его полного отделения от ядра. Квантовое состояние атома с наименьшей энергией Е1 (т.е. для n = 1) называется нормальным; остальные квантовые состояния с более высокими уровнями энергии Е2, Е3, Е4… называются возбужденными. Электроны с одинаковым значением n образуют один энергетический уровень (или электронный слой, или электронную оболочку).
Чем больше n,тем дальше от ядра атома располагается область наиболее вероятного нахождения электрона, т.е. n определяет средний радиус нахождения электрона в атоме.
Побочное (орбитальное) квантовое число (l) характеризует различное энергетическое состояние электронов на данном уровне, определяет форму электронного облака. При данном главном квантовом числе n орбитальное квантовое число l может принимать любые целые значения от 0 до n – 1 (l = 0, 1, 2, … n – 1). В пределах определенных уровней энергии электроны могут отличаться своими энергетическими подуровнями.
Электроны с одинаковыми значениями n и l образуют электронный подуровень (или подслой, или подоболочку). Электроны с различными орбитальными квантовыми числами отличаются друг от друга: их энергия тем выше, чем больше число l. Каждому значению l соответствует определенный энергетический подуровень.
Для слоя n = 1 существует только одно значение l = n – 1 = 0. Это s -орбиталь; электронное облако имеет шаровидную форму (сферическую симметрию) и не обладает направленностью в пространстве; расположенные на ней электроны называют s -электронами.
|
|
|
Для слоя с n = 2 значения l могут быть l = 0 (s -), l = 1 (p -); электронное облако имеет форму гантели, т.е. форму тела вращения, полученного из «восьмерки»; электроны называют p -электронами.
Для слоя с n = 3 значения l могут быть l = 0 (s -), l = 1 (p -), l = 2 (d -); электронное облако представляет собой ²четырехлепестковую² фигуру; расположенные на ней электроны называют d -электронами.
Ориентацию орбиталей в пространстве определяет третье квантовое число, называемое магнитным (ориентационным) m1. При данном орбитальном квантовом числе l магнитное квантовое число m1 может принимать любые значения от − l до + l, т.е. всего (2 l + 1) значений.
Для l = 0 (s -подуровень) возможно значение ml = 0, т.е. только одна проекция орбитального момента электрона на магнитную ось атома:
 |
Для l = 1 возможны значения ml = −1, 0 и +1, т.е. возможны три проекции орбитального момента электрона на магнитную ось атома:
 |
Для l = 2 возможны значения ml = −2, −1, 0, +1, +2, т.е. на d -подуровне возможны пять различных ориентаций электронного облака:
 |
Для f -подуровня значения магнитного квантового числа могут быть: m1 = −3, −2, −1, 0, +1, +2, +3, итого семь АО:
 |
Спиновое квантовое число ms (спин электрона) отражает наличие у электрона собственного момента движения. Спин – это собственный момент импульса электрона, не связанный с движением в пространстве. Для всех электронов абсолютное значение спина всегда равно s = 1/2. Проекция спина на ось z (магнитное спиновое число ms) может принимать два численных значения:
ms = + 1/2; − 1/2
Спин электрона ms является величиной постоянной.
 2015-02-27
2015-02-27 837
837







