
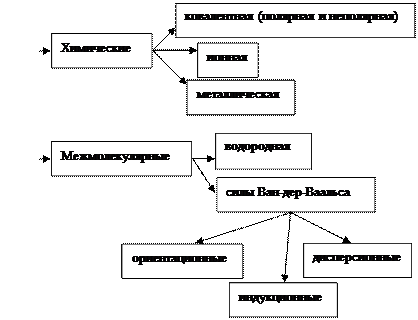
Ковалентная – связь, осуществляемая за счет образования электронных пар, в одинаковой мере принадлежащих обоим атомам. Ковалентная связь может возникать не только между одинаковыми (H2, O2, N2), но и между разными атомами (HCI, H2S).
Ковалентные соединения – жидкие, газообразные, имеют низкие температуры кипения и плавления.
Ионная – связь, возникающая между ионами. Происходит полная передача электрона от одного атома к другому:
К+CI− K – 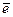 = K+ CI +
= K+ CI + 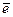 = CI−
= CI−
4 s 1 4 s 0 3 p 5 3 p 6
Атомы более электроотрицательных элементов (неметаллы) дополняют свой внешний энергетический уровень за счет электронов атомов менее электроотрицательных элементов (металлов), у которых предвнешний уровень становится внешним уровнем: Δ ЭО = 2,8 – 0,9 = 1,9. Она направлена и насыщаема. Ионные соединения имеют высокие температуры кипения и плавления, твердые вещества.
Металлическая связь возникает между атомами в металлах. Характерной особенностью является небольшое число электронов на внешнем уровне, слабо удерживаемых ядром, и большое число свободных атомных орбиталей с близкой энергией.
|
|
|
Образована массовым перекрыванием электронных облаков атомов в кристалле, свободное перемещение электронов по кристаллической решетке металла, делокализация электронов. Такой тип связи обеспечивает пластичность, электро- и теплопроводность, высокие температуры плавления и кипения металлов.
Водородная – характерна для соединений, молекулы которых имеют сильно полярные ковалентные связи, образованные атомами водорода и электроотрицательных элементов II периода (H–F, –O–H, =N–H). Наиболее характерна для соединений фтора и кислорода, в меньшей степени для азота, серы и галогенов.
Межмолекулярные взаимодействия (силы Ван-дер-Ваальса) – это химическая связь, которая осуществляется без передачи электронов атомами. Эти силы определяются физическими свойствами вещества и имеют электростатическую природу и складываются из трех составляющих:
· ориентационное взаимодействие – взаимодействие между диполями, т.е. полярными молекулами;
· индукционное взаимодействие – взаимодействие между полярной и неполярной молекулами;
· дисперсионное взаимодействие – взаимодействие между неполярными молекулами в момент образования из них мгновенных диполей.
Валентность элемента – мера его способности образовывать химические связи. В образовании связей принимают участие электроны внеш-
них уровней для s - и р -элементов; внешних и предвнешних для d - и f -элементов.
Валентность атома определяется числом образуемых ковалентных связей. Число образуемых связей зависит от числа неспаренных электронов и атомных орбиталей, которые могут участвовать в образовании ковалентных связей по обменному или донорно-акцепторному механизмам.
|
|
|
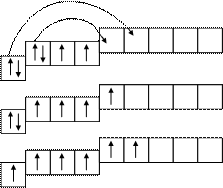 |
S:…3 s 23 p 4 W = 2
S*:3 s 23 p 33 d 1 W = 4
S*:3 s 13 p 33 d 2 W = 6
Число неспаренных электронов может увеличиться при переходе aтома из нормального в возбужденное состояние за счет "распаривания" электрона. Распаривание электронов возможно лишь в пределах одного электронного уровня.
 2015-02-27
2015-02-27 559
559








