Теория была сформулирована С. Аррениусом в 1889 году. В основе этой теории лежит представление о том, что для протекания химической реакции необходимо соударение между молекулами исходных веществ, а число соударений определяется интенсивностью теплового движения молекул, т.е. зависит от температуры. Но не каждое соударение молекул приводит к химическому превращению – к нему приводит лишь активное соударение. Тот минимальный запас энергии, которым должны обладать молекулы исходных веществ для того, чтобы их соударение было активным, называют энергетическим барьером реакции. Наглядное представление об энергетическом барьере реакции дает графическое изображение энергетики химической реакции. То дополнительное количество энергии, которое нужно добавить к средней энергии молекул исходных веществ, чтобы соударение стало активным, называется энергией активации. Энергия активации ощутимо влияет на значение константы скорости реакции и ее зависимости от температуры: чем больше Еа, тем меньше константа скорости и тем значительнее влияет на нее изменение температуры. Константа скорости реакции связана с энергией активации сложной зависимостью, описанной уравнением Аррениуса: 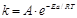 Используя уравнение Аррениуса, можно определить энергию активации Еа. Для этого уравнение Аррениуса удобно применять в логарифмической форме:
Используя уравнение Аррениуса, можно определить энергию активации Еа. Для этого уравнение Аррениуса удобно применять в логарифмической форме: 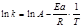 Теория активных соударений внесла в химическую кинетику новые представления об активных соударениях и об энергии активации, но эта теория не рассматривала механизм самого соударения, что является ее недостатком.
Теория активных соударений внесла в химическую кинетику новые представления об активных соударениях и об энергии активации, но эта теория не рассматривала механизм самого соударения, что является ее недостатком.
|
|
|
42. Теория переходного комплекса как пример статистического подхода к описанию механизма химической реакции. Вывод основного уравнения теории переходного комплекса. Эта теория – простейший и исторически первый вариант статистической теории химических реакций. Она разработана Э. Вагнером, М. Поляни, Г. Эйрнингом и М. Эвансом в 30-х годах XX века. Вывод основного уравнения теории
переходного состояния: В основу теории также положено представление о столкновении молекул как непременном условии реакции. Но она рассматривает то, что происходит в момент столкновения. Для реакции А + В = С в соответствии с теорией переходного состояния следует: А + В «х* ® С, где х* – переходной комплекс (пк). Что подразумевается под переходным комплексом? После столкновения молекул А и В начинается перераспределение химических связей и образование переходного комплекса. переходный комплекс представляет такое состояние взаимодействующих молекул, когда старые связи еще не полностью разорвались, а новые еще не полностью сформировались. В результате мы имеем состояние промежуточное между А, В и С. Переходное состояние характеризуется непрерывным изменением расстояний между взаимодействующими атомами. В этом существенное отличие переходного комплекса от обычной молекулы, в которой средние расстояния между атомами не зависят от времени. Переходный комплекс также не следует путать с промежуточными веществами. Он является динамической структурой, для образования которой требуется затрата энергии. Энергия, необходимая для перевода реагирующих молекул в состояние переходного комплекса, носит название энергии активации. Так как исходные молекулы еще не распались, то энергия перехода в активированное состояние меньше энергии разрыва связей в молекулах исходных веществ: Еа < Едиссоциации. Таким образом, формирование переходного комплекса – процесс энергетически более выгодный, чем полный распад вступающих в реакцию молекул. С другой стороны, превращение активированного комплекса в продукты реакции всегда является экзотермическим процессом. Основной постулат теории переходного состояния заключается в том, что исходные вещества всегда находятся в равновесии с переходным комплексом: А + в «х* ® С. В этом случае k химического равновесия переходного комплекса равна: 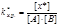 , (8.31) а концентрация х составит:
, (8.31) а концентрация х составит: 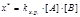 . (8.32) Затем ПК распадается необратимо с образованием продукта С. Характеристикой (количественной) распада будет частота распада ПК – Р. Из статистической механики известно, что Р зависит только от температуры. Эта зависимость имеет вид Р = kТ / h, где k – постоянная Больцмана; h – постоянная Планка; Т – абсолютная температура. Значит, для данной температуры число Р одинаково для всех переходных состояний, а скорость любой химической реакции определяется лишь концентрацией ПК:
. (8.32) Затем ПК распадается необратимо с образованием продукта С. Характеристикой (количественной) распада будет частота распада ПК – Р. Из статистической механики известно, что Р зависит только от температуры. Эта зависимость имеет вид Р = kТ / h, где k – постоянная Больцмана; h – постоянная Планка; Т – абсолютная температура. Значит, для данной температуры число Р одинаково для всех переходных состояний, а скорость любой химической реакции определяется лишь концентрацией ПК: 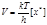 . (8.33) Концентрация ПК связана с концентрацией реагентов и поэтому, подставив их выражения, получим:
. (8.33) Концентрация ПК связана с концентрацией реагентов и поэтому, подставив их выражения, получим: 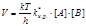 . (8.34) К элементарной реакции взаимодействия применим закон действия масс: V = kV[А][B], (8.35) символ k V употребляется для константы скорости в отличие от константы Больцмана. Приравняем правые части уравнений и получим:
. (8.34) К элементарной реакции взаимодействия применим закон действия масс: V = kV[А][B], (8.35) символ k V употребляется для константы скорости в отличие от константы Больцмана. Приравняем правые части уравнений и получим: 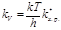 (8.36) или
(8.36) или 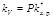 . (8.37) Из уравнения видно, что при данной температуре константа скорости реакции зависит от константы химического равновесия образования ПК и от частоты распада ПК. Уравнение называется основным уравнением теории переходного состояния.
. (8.37) Из уравнения видно, что при данной температуре константа скорости реакции зависит от константы химического равновесия образования ПК и от частоты распада ПК. Уравнение называется основным уравнением теории переходного состояния.
|
|
|
 2015-02-04
2015-02-04 8438
8438
