Первое доказательство того, что вещества, имеющие одинаковое химическое строение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. Независимо друг от друга в 1906 г. Б.Болтвуд и в 1907 г. Г.Мак-Кой и В.Росс обнаружили, что продукт радиоактивного распада урана - ионий и продукт радиоактивного распада тория - радиоторий имеют одни и те же химические свойства, что и торий, однако отличаются от последнего атомной массой и характеристиками радиоактивного распада. Более того, как было обнаружено позднее, все три элемента имели одинаковые оптические и рентгеновские спектры излучений.
 Одним из главных открытий выдающегося англий-
Одним из главных открытий выдающегося англий-
ского радиохимика ФредерикаСодди стало откры-
тие явления изотопии элементов (Нобелевская пре-
мия по химии, 1921). Изотопы - это разновидности атомов одного и того же элемента, занимающие в периодической системе одно и то же место. Термин «изотоп» был предложен Содди в 1910 г. на основе
|
|
|
Ф.Содди (1877-1956) двух греческих слов: isos - «равный», «одинаковый» и topos - «место».
Другими словами, изотопы это разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра, но разную атомную массу. Ф.Содди говорил, что изотопы одинаковы «снаружи», но
отличаются «внутри».
 Независимо от американского физико-химика польс-
Независимо от американского физико-химика польс-
кого происхождения Казимира Фаянса, Содди сфор-
мулировал закон радиоактивного смещения (1913 г.). Его основной смысл сводится к следующему: при из-
лучении альфа-частиц происходит превращение одно-
го элемента в изотоп другого, расположенного на два места ниже в периодической таблице, а бета-излуче-
К.Фаянс (1887-1975) ние вызывает подобное смещение на одно место вы-
ше.
Закон смещения дал возможность предсказывать последовательность распада многих радиоактивных элементов, определяя образующиеся таким образом элементы на основе вида излучения и включая их в таблицу периодической системы. Сначала Ф.Содди нашел изотопы нескольких радиоактивных элементов, а потом обнаружил и нерадиоактивные. Отличить изотопы друг от друга Содди смог из-за различия их физических свойств.
В 1920 г. Содди предсказал, что изотопы можно использовать для определения геологического возраста горных пород и окаменелостей, поскольку известна скорость их радиоактивного распада.
 Это предположение, в конечном счете, привело к раз-
Это предположение, в конечном счете, привело к раз-
витию современной технологии радиоактивного дати-
рования. Например, к появлению в 1947 г. метода датирования с помощью углерода-14, разработанного аме-
риканским химиком Уиллардом Либби (Нобелевская премия по химии, 1960).
|
|
|
Справедливость и точность этого метода были прове-
рены им при определении возраста сердцевины стволов
У.Либби (1908-1980) шеститысячелетних секвой и дугласских пихт. Результаты радиоуглеродного метода сравнивались с количеством годовых колец.
У. Либби обнаружил, что результаты вычислений по его методу и с помощью
подсчета годовых колец совпали. Он также участвовал в разработке метода газодиффузионного выделения изотопа U235 из природного урана.
На рис. 14 показан процесс образования радиоизотопа С 14 в атмосфере и стадии его прохождения к конечному месту депонирования в растениях и животных согласно теории Уилларда Либби.
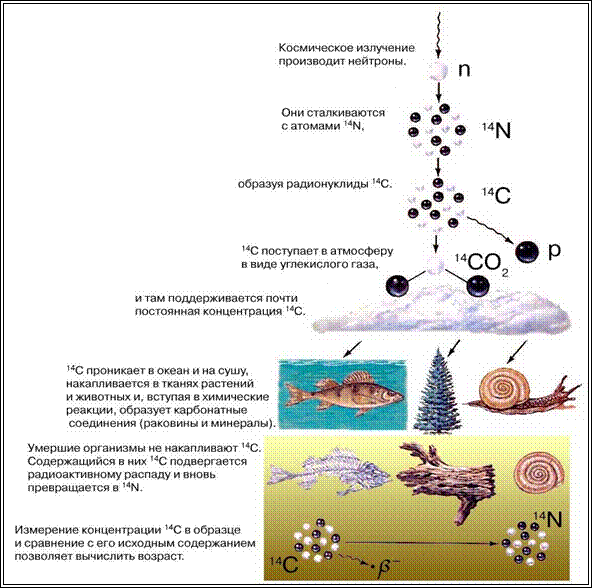
Рис. 14. Схема образования и миграции углерода-14 (по У. Либби)
Существует несколько методов измерения радиоактивности углерода. Один из них основан на определении количества электронов, выделяющихся в процессе распада С14. Интенсивность их выделения соответствует количеству С14 в исследуемом образце. Время подсчета составляет до нескольких суток, т.к. за сутки происходит распад всего лишь примерно четверти миллионной доли содержащегося в образце количества атомов С14.
Другой метод требует использования масс-спектрометра, с помощью которого выявляются все атомы с массой, равной 14. При этом особый фильтр позволяет различать N14 и С14. Поскольку при этом нет необходимости ждать, пока произойдет распад, подсчет С14 можно осуществить менее, чем за час, имея образец массой в 1 мг. Прямой масс-спектрометрический метод называют АМС-датиров-
кой. При этом используются сложные высокочувствительные приборы, которыми располагают, как правило, центры, ведущие исследования в области ядерной физики.
 Большой вклад в развитие учения об изотопах внес также выдающийся английский химик Фрэнсис Астон. В 1913 г. он совместно с Дж.Томсоном впервые получил подтверждение существования стабильных изотопов у неона. Им был сконструирован первый масс-спектрометр, с помощью которого были откры-
Большой вклад в развитие учения об изотопах внес также выдающийся английский химик Фрэнсис Астон. В 1913 г. он совместно с Дж.Томсоном впервые получил подтверждение существования стабильных изотопов у неона. Им был сконструирован первый масс-спектрометр, с помощью которого были откры-
ты 213 устойчивых изотопов химических элементов и определена ихотносительная распространенность.
 2015-02-04
2015-02-04 962
962








