Задача 1. Вычислить ЭДС хингидронно-каломельной  цепи с насыщенным раствором хлорида калия, если рН исследуемого раствора равен 3,52, а температура +18°С.
цепи с насыщенным раствором хлорида калия, если рН исследуемого раствора равен 3,52, а температура +18°С.
Решение:
pH = –lg a [H+]
ЭДС = Ех – Ек, (по таблице учебника Ек = 0,2503 В).
По уравнению Нернста:
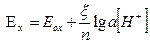 , n – валентность водорода равна 1
, n – валентность водорода равна 1
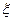 = 0,0581 В Еох = 0,7044 В.
= 0,0581 В Еох = 0,7044 В.
ЭДС= 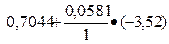 = 0,7044-0,0581•3,52 - 0,2503=0,2496 В.
= 0,7044-0,0581•3,52 - 0,2503=0,2496 В.
Ответ: 0,2496 В.
Задача 2. Потенциал цинкового электрода равен – 0,926 В. Вычислить степень диссоциации соли, цинка, если ЕZn = – 0,7636 В. Значение 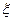 равно 0,058, концентрация раствора 0,15•10–4моль/л.
равно 0,058, концентрация раствора 0,15•10–4моль/л.
Решение:
По уравнению Нернста:
aZn2+ =α•c, n = 2
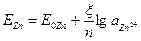
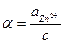
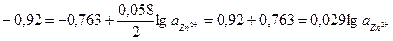
– 0,157 = 0,029 lg aZn2+
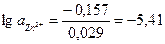
lg 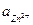 = 3,89•10–6 моль/л
= 3,89•10–6 моль/л 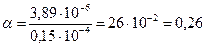
Ответ: 0,26
Задача 3. Электродвижущая сила гальванического элемента, составленного из насыщенного каломельного и никелевого электродов, равна при 25°С 0,472 В. Определить потенциал никелевого электрода. Записать уравнения электродных реакций.
Решение:
Записываем гальваническую цепь:
(-) Ni/NiCl2//KClнасыщ.//Hg2Cl2/Hg(+)
ЭДС этого элемента: ЭДС = Ек - ЕNi2+/Ni
Электродный потенциал каломельного насыщенного электрода при 25°С равен 0,242 В. Тогда: ЕNi2+/Ni= Ек - ЭДС
|
|
|
ЕNi2+/Ni= 0,242 – 0,472 = -0,23 В
На никелевом электроде протекает реакция окисления, на каломельном - рнакция восстановления:
(-) Ni -2ē → Ni2+
(+)Hg2Cl2 + 2ē → 2Hg0+ 2Cl-
Ответ: -0,23 В
Задача 4. Вычислить ЭДС гальванического элемента при 25°С:
(-)Tl/TlCl // CuSO4/Cu(+)
0,01 моль 0,1 моль
Решение:
Из справочника нормальные электродные потенциалы меди и таллия:
ЕCu/Cu2+=0,34 В ЕTl/Tl+= -0,335 В
средние коэффициенты активности солей сульфата меди и хлорида таллия указанной моляльности: γ±= 0,154 и γ±= 0,876
Средние активности ионов меди и таллия равны:
аCu2+= 0,1•0,154=0,0154 и а Tl+= 0,01•0,876 = 0,00876
ЭДС = ЕCu/Cu2+ - ЕTl/Tl+
Потенциалы медного и таллиевого электродов находим по формуле Нернста для металлических электродов:
ЭДС = 0,35+0,335+ 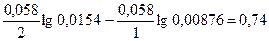 В
В
Ответ: 0,74 В
Задача 5. Вычислить потенциал хингидронного электрода, если рН раствора равен 3.
Решение:
Потенциал электрода вычисляется по формуле:
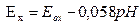 Еок=0,699 В
Еок=0,699 В
Ех= 0,699 – 0,058•3=0,522 В
Ответ: 0,522 В.
 2015-02-04
2015-02-04 10388
10388
